
【题目】榴石矿石可以看作CaO、FeO、Fe2O3、Al2O3、SiO2组成。工业上对其进行综合利用的流程如下:
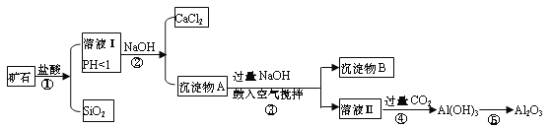
(1)用方程式表示盛放氢氧化钠溶液的试剂瓶不能用玻璃塞的原因________;
(2)溶液Ⅰ中除了Ca2+外,还可能含有的金属阳离子有_______________;
(3)步骤③中NaOH参加反应的离子方程式是________________,鼓入空气并充分搅拌的目的是_____________________。
(4)在工业生产中,步骤④通入过量CO2而不加入盐酸的原因是___________;写出步骤④通入过量CO2的离子方程式 _________________________________。
(5)试设计实验证明榴石矿中含有FeO(试剂任选,说明实验操作与现象)_________。
【答案】2 NaOH+SiO2 =Na2 SiO3 +H2OH+、Al3+、Fe3+ 、Fe2+Al (OH)3+OH-===AlO2-+2H2O使氢氧化亚铁全部转化为氢氧化铁使用二氧化碳可以避免盐酸过量导致生成的氢氧化铝溶解,同时二氧化碳容易制取且价格便宜AlO2-+2H2O + CO2 =Al (OH)3 +HCO3-取少量矿石,加稀硫酸溶解后,向其中滴加酸性的高锰酸钾溶液,若紫色退去,证明矿石中含有FeO (加盐酸溶解或取溶液Ⅰ进行实验不得分)
【解析】
榴石矿石可以看作CaO、FeO、Fe2O3、A12O3、SiO2组成,加入盐酸溶解过滤得到滤液中含氯化钙、氯化亚铁、氯化铁、氯化铝、盐酸,固体为SiO2,溶液中加入氢氧化钠反应生成氢氧化铁、氢氧化亚铁、氢氧化铝,过滤得到沉淀物A加热过量氢氧化钠通入空气,氧化氢氧化亚铁生成沉淀物氢氧化铁和溶液Ⅱ为偏铝酸钠溶液,通入过量二氧化碳生成氢氧化铝沉淀,加热分解生成氧化铝;
(1)二氧化硅是酸性氧化物和碱反应生成盐和水;
(2)溶液Ⅰ除去钙离子,含有阳离子H+、Fe2+、Fe3+、Al3+;
(3)步骤③中NaOH参加反应和氢氧化铝反应生成偏铝酸钠溶液,鼓入空气充分搅拌是为了氢氧化亚铁氧化为氢氧化铁;
(4)步骤④通入过量CO2而不加入盐酸的原因是避免盐酸过量使氢氧化铝溶解,二氧化碳制备方法简单价格便宜,过滤的二氧化碳和偏铝酸钠反应生成氢氧化铝沉淀和碳酸氢钠;
(5)取少量矿石加入稀硫酸溶解后加入高锰酸钾溶液若褪色证明含有氧化亚铁。
榴石矿石可以看作CaO、FeO、Fe2O3、A12O3、SiO2组成,加入盐酸溶解过滤得到滤液中含氯化钙、氯化亚铁、氯化铁、氯化铝、盐酸,固体为SiO2,溶液中加入氢氧化钠反应生成氢氧化铁、氢氧化亚铁、氢氧化铝,过滤得到沉淀物A加热过量氢氧化钠通入空气,氧化氢氧化亚铁生成沉淀物氢氧化铁,和溶液Ⅱ为偏铝酸钠溶液,通入过量二氧化碳生成氢氧化铝沉淀,加热分解生成氧化铝;
(1)玻璃中的二氧化硅和氢氧化钠溶液反应,生成硅酸钠和水,反应的化学方程式为:2NaOH+SiO2=Na2SiO3+H2O,
故答案为:2NaOH+SiO2=Na2SiO3+H2O;
(2)依据流程分析判断,溶液Ⅰ除去钙离子,含有阳离子Fe2+、Fe3+、Al3+,溶液ⅠpH<1,说明盐酸过量,溶液中还含有H+,
故答案为:H+、Fe2+、Fe3+、Al3+;
(3)步骤③中NaOH参加反应和氢氧化铝反应生成偏铝酸钠溶液,反应的离子方程式为:Al(OH)3+OH﹣═AlO2-+2H2O,鼓入空气充分搅拌是为了氢氧化亚铁氧化为氢氧化铁,
故答案为:Al(OH)3+OH﹣═AlO2-+2H2O;使氢氧化亚铁全部转化为氢氧化铁;
(4)步骤④通入过量CO2而不加入盐酸的原因是避免盐酸过量使氢氧化铝溶解,二氧化碳制备方法简单价格便宜,步骤④通入过量CO2的反应是二氧化碳和偏铝酸钠溶液反应生成氢氧化铝沉淀和碳酸氢钠,反应的离子方程式为:AlO2-+2H2O + CO2 =Al (OH)3 +HCO3-,
故答案为:使用二氧化碳可以避免盐酸过量导致生成的氢氧化铝溶解,同时二氧化碳容易制取且价格便宜;AlO2-+2H2O + CO2 =Al (OH)3 +HCO3-;
(5)取少量矿石,加稀硫酸溶解后,向其中滴加酸性的高锰酸钾溶液,若紫色退去,证明矿石中含有FeO,
故答案为:取少量矿石,加稀硫酸溶解后,向其中滴加酸性的高锰酸钾溶液,若紫色退去,证明矿石中含有FeO。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】元素周期表中第三周期包括Na、Mg、Al、Si、P、S、Cl、Ar 8种元素。请回答下列问题:
(1)基态磷原子核外有________种运动状态不同的电子。
(2)第三周期8种元素按单质熔点(℃)大小顺序绘制的柱形图(已知柱形“1”代表Ar)如下所示,则其中“2”原子的结构示意图为________,“8”单质晶体的类型为________。


(3)氢化镁
储氢材料的晶胞结构如图所示,已知该晶体的密度为ρ g·cm-3,则该晶体的化学式为________,晶胞的体积为________cm3(用ρ、NA表示,其中NA表示阿伏加德罗常数的值)。
(4)实验证明:KCl、MgO、CaO三种晶体的结构与NaCl晶体的结构相似,已知NaCl、KCl、CaO晶体的晶格能数据如下表:
晶体 | NaCl | KCl | CaO |
晶格能/(kJ·mol-1) | 786 | 715 | 3 401 |
则KCl、MgO、CaO三种晶体的熔点从高到低的顺序是________________。其中MgO晶体中一个Mg2+周围和它最近且等距离的Mg2+有________个。
(5)Si、C和O的成键情况如下:
化学键 | C-O | C=O | Si-O | Si=O |
键能/(kJ·mol-1) | 360 | 803 | 464 | 640 |
C和O之间易形成含有双键的CO2分子晶体,而Si和O之间则易形成含有单键的SiO2原子晶体,请结合数据分析其原因:__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。

根据判断出的元素回答问题:
上述元素可组成盐R:zx4f(gd4)2。向盛有10mL 1mol·L-1R溶液的烧杯中滴加1mol·L-1NaOH溶液,沉淀物质的量随NaOH溶液体积的变化示意图如下:

(1)R溶液中,离子浓度由大到小的顺序是___________________________________
(2)写出m点反应的离子方程式:__________________________________________。
(3)若在R溶液中改加20mL 1.2mol·L-1 Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为________ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去NaCl中含有的Ca2+、Mg2+、SO42-、HCO3-等离子,通常采用以下四种试剂:
①Na2CO3 ②BaCl2 ③NaOH ④HCl。加入试剂合理的操作顺序是
A.①②③④B.③①②④C.③②①④D.④②①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成氨的反应为N2(g)+3H2(g)![]() 2NH3(g)是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1 mol H—H键、1 mol N—H键、1 mol N≡N键放出的能量分别为436 kJ、391 kJ、946 kJ。则:
2NH3(g)是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1 mol H—H键、1 mol N—H键、1 mol N≡N键放出的能量分别为436 kJ、391 kJ、946 kJ。则:
(1)若1 mol氮气完全反应生成氨气可放出的能量为________ kJ。
(2)如果将1 mol氮气和3 mol氢气混合,使充分反应,反应放出的能量总小于上述数值,为什么___________?
(3)实验室模拟工业合成氨时,在容积为2 L的密闭容器内,反应经过10分钟后,生成10 mol 氨气,则用氮气表示的化学反应速率是________ mol·L-1·min-1。
(4)一定条件下,当合成氨的反应达到化学平衡时,下列说法正确的是________。
a.正反应速率和逆反应速率相等
b.正反应速率最大,逆反应速率为0
c.氮气的转化率达到最大值
d.氮气和氢气的浓度相等
e.N2、H2和NH3的体积分数相等
f.反应达到最大程度
(5)根据题目所给条件,判断影响该反应速率的因素有________、________、__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu2O是一种鲜红色粉末状固体,几乎不溶于水,在酸性溶液中歧化为二价铜和铜单质。可用于制造船底防污漆等。某校合作学习小组的同学设计实验验证其某些性质及其胶体的制法。回答下列问题:
(1)甲组同学检验H2还原CuO所得的红色粉末中是否有Cu2O。取反应产物少许加入试管中,加入足量的试剂X并搅拌,若发现溶液变蓝且仍有剩余固体,则试剂X可选用_________(填序号)。
a.FeCl3溶液 b.硝酸 c.稀硫酸 d. H2O2酸性溶液
(2)乙组同学在两支试管中分别加入少量Cu2O,一支中加入稀硝酸,固体溶解同时产生NO气体,Cu2O表现_______________性;另一支加入硫酸酸化的KMnO4溶液,溶液紫色褪去得蓝色溶液,反应的离子方程式为______________。
(3)丙组同学取少量Cu2O与黑色的Cu2S混合加强热,产生大量的气体同时得到红色固体粉末,该反应的化学方程式为____________________。
(4)丁组同学向0.1mol·L-1 的(CH3COO)2Cu溶液中加入0.02mol·L-1的N2H4的水溶液,控制pH=7~8,得到红色透明液体,能说明该分散系属于胶体的简单方法是____________。已知制备过程中有N2放出,制备反应的化学方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铁的氧化物(FexO)1.52 g溶于足量盐酸中,向所得溶液中通入标准状况下112 mL Cl2,恰好将Fe2+完全氧化。下列说法正确的是( )
A. FexO溶于足量盐酸后只生成了FeCl3和H2O
B. 标准状况下112 mL Cl2的物质的量是5 mol
C. x=0.8
D. 通入Cl2后,发生反应的离子方程式:Fe2++Cl2![]() Fe3++2Cl﹣
Fe3++2Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年10月5日,中国著名药学家屠呦呦获得诺贝尔奖生理学或医学奖,获奖理由是“因为发现青蒿素一一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命”。青蒿素是从植物黄花蒿茎叶中提取的,其结构简式如下图,下列说法不正确的是
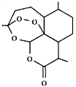
A. 它的分子式为C15H22O5
B. 该分子中有6个手性碳原子
C. 因其具有过氧基团,它不稳定,易受湿、热和还原性物质的影响而变质
D. 它在常见有机溶剂中的溶解度大于在水中的溶解度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C为中学常见单质,其中一种为金属;通常情况下A为固体、B为黄绿色气体、C为无色气体。D、E、F、G、H、X均为化合物,其中X常温下是无色气体,其水溶液是一种无氧强酸溶液,E为黑色固体,H在常温下为液体。它们之间的转化关系如图所示(其中某些反应条件和部分反应产物已略去)。
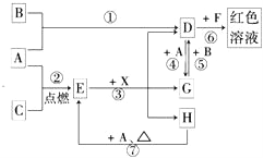
(1)写出下列物质的化学式:D___________,X_______________。
(2)在反应①~⑦中,不属于氧化还原反应的是_____________(填编号)。
(3)反应⑥的离子方程式为:______________________________________。
(4)往G溶液中加入NaOH溶液观察到的现象是________________________。
(5)反应⑦的化学方程式为____________________________________;该反应中每消耗0.3mol的A,可转移电子________mol。
(6)除去D溶液中混有的少量G的化学方程式:_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com