
【题目】工业合成氨的反应为N2(g)+3H2(g)![]() 2NH3(g)是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1 mol H—H键、1 mol N—H键、1 mol N≡N键放出的能量分别为436 kJ、391 kJ、946 kJ。则:
2NH3(g)是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1 mol H—H键、1 mol N—H键、1 mol N≡N键放出的能量分别为436 kJ、391 kJ、946 kJ。则:
(1)若1 mol氮气完全反应生成氨气可放出的能量为________ kJ。
(2)如果将1 mol氮气和3 mol氢气混合,使充分反应,反应放出的能量总小于上述数值,为什么___________?
(3)实验室模拟工业合成氨时,在容积为2 L的密闭容器内,反应经过10分钟后,生成10 mol 氨气,则用氮气表示的化学反应速率是________ mol·L-1·min-1。
(4)一定条件下,当合成氨的反应达到化学平衡时,下列说法正确的是________。
a.正反应速率和逆反应速率相等
b.正反应速率最大,逆反应速率为0
c.氮气的转化率达到最大值
d.氮气和氢气的浓度相等
e.N2、H2和NH3的体积分数相等
f.反应达到最大程度
(5)根据题目所给条件,判断影响该反应速率的因素有________、________、__________。
【答案】92 该反应是可逆反应,1 mol氮气和3 mol 氢气不能完全反应,放出的能量总是小于92 kJ 0.25 acf 温度 压强 催化剂
【解析】
(1)根据断键吸热、形成化学键放热分析解答;
(2)根据反应是可逆反应分析解答;
(3)根据v=△c/△t结合反应速率之比是化学计量数之比计算;
(4)根据平衡状态的含义、特征分析解答;
(5)根据影响反应速率的外界条件分析解答。
(1)由化学方程式3H2(g)+N2(g)![]() 2NH3(g)可知,1mol氮气完全反应需要消耗3 mol氢气,可生成2 mol 氨气。拆开3 mol H—H键和1 mol N≡N键需要吸收的能量为436 kJ×3+946 kJ=2254 kJ,但是生成2 mol氨气即生成6 mol N—H键可放出能量391 kJ×6=2346 kJ,因此放出的能量为2346 kJ-2254 kJ=92 kJ。
2NH3(g)可知,1mol氮气完全反应需要消耗3 mol氢气,可生成2 mol 氨气。拆开3 mol H—H键和1 mol N≡N键需要吸收的能量为436 kJ×3+946 kJ=2254 kJ,但是生成2 mol氨气即生成6 mol N—H键可放出能量391 kJ×6=2346 kJ,因此放出的能量为2346 kJ-2254 kJ=92 kJ。
(2)由于该反应是可逆反应,1 mol氮气和3 mol氢气不能完全反应,因此放出的能量总是小于92 kJ 。
(3)Δc(NH3)=10 mol÷2 L=5 mol·L-1,v(NH3)=5 mol·L-1÷10 min=0.5 mol·L-1·min-1,反应速率之比是化学计量数之比,则v(N2)=1/2v(NH3)=0.25 mol·L-1·min-1。
(4)a.反应达到化学平衡时正反应速率和逆反应速率相等,a正确;
b.反应达到化学平衡时正反应速率和逆反应速率相等,但不为0,b错误;
c.反应达到化学平衡时氮气的转化率达到最大值,c正确;
d.反应达到化学平衡时氮气和氢气的浓度不再发生变化,但二者不一定相等,d错误;
e.反应达到化学平衡时N2、H2和NH3的体积分数不再发生变化,但不一定相等,e错误;
f.反应达到化学平衡时即表明反应达到最大程度,f正确;
答案选acf;
(5)根据题意“反应条件是高温、高压,并且需要合适的催化剂”可知该反应的速率受温度、压强和催化剂的影响。


科目:高中化学 来源: 题型:
【题目】同温同压下,两个等体积的干燥圆底烧瓶中分别充满①NH3②NO2进行喷泉实验,如图所示,经充分反应后,瓶内溶液的物质的量浓度为( )
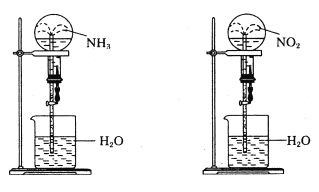
A. ①>② B. ①<② C. ①=② D. 不能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)基态Ga原子中能量最高的能层符号________ 有______ 种不同能量的电子,Ga元素与同周期相邻元素Zn、Ge相比,第一电离能从大到小的顺序__________,(用元素符号表示)金属Zn晶体采用六方最密堆积,其密置层堆积方式为__________ (ABABAB或ABCABC)区分晶体和非晶体最可靠的科学方法是________________。
(2)磷有三种含氧酸 H3PO2 、 H3PO3 、 H3PO4 其中磷原子均以sp3杂化与相邻原子形成四个α 键,则①H3PO3的结构式是__________;②写出H3PO2 与足量强氧化钠溶液反应的化学方程式_________;③三种酸的强弱顺序为H3PO2 <H3PO3 < H3PO4,其原因是___________;④HNO3 、 HNO2 中心原子的杂化方式分别为__________。
(3)金属铜投入氨水或过氧化氢溶液中均无明显现象,但投入氨水和过氧化氢的混合溶液中,则铜片溶解,溶液呈深蓝色。①写出该反应的离子反应方程式____________________________ ;②已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,原因是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外活动小组从实验室取出硫酸试剂,试剂瓶上标签的部分内容如图所示。该小组欲配制450 mL 0.2 mol·L-1的稀H2SO4溶液:

(1)所需试剂瓶内硫酸溶液的体积为________mL。
(2)所用量筒和容量瓶的规格为________和________。
(3)浓硫酸稀释时的操作是________________________。
(4)下列为该小组的操作,可能导致配制溶液浓度偏高的是________。
A.移液前未冷却至室温
B.定容时加水多了,用滴管吸出
C.定容时俯视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由Fe2O3、Fe、CuO、C、Al中的几种物质组成的混合粉末,取样品进行下列实验(部分产物略去):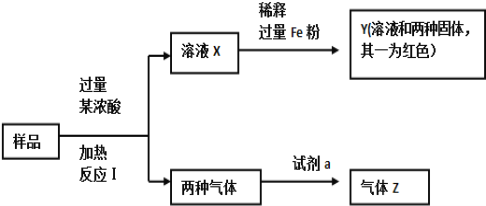
(1)取少量溶液X,加入过量的NaOH溶液,有沉淀生成。取上层清液,通入CO2,无明显变化,说明样品中不含有的物质是(填写化学式)______________。
(2)Z为一种或两种气体:
①若Z只为一种气体,试剂a为饱和NaHCO3溶液,则反应I中能同时生成两种气体的化学方程式是_______________________________________________________。
②若Z为两种气体的混合物,试剂a为适量水,则Z中两种气体的化学式是_________________。
(3)向Y中通入过量氯气,并不断搅拌,充分反应后,溶液中的阳离子是(填写离子符号)___________________________。
(4)取Y中的溶液,调pH约为7,加入淀粉KI溶液和H2O2,溶液呈蓝色并有红褐色沉淀生成。当消耗2 mol I-时,共转移3 mol电子,该反应的离子方程式是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】榴石矿石可以看作CaO、FeO、Fe2O3、Al2O3、SiO2组成。工业上对其进行综合利用的流程如下:
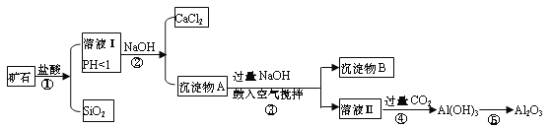
(1)用方程式表示盛放氢氧化钠溶液的试剂瓶不能用玻璃塞的原因________;
(2)溶液Ⅰ中除了Ca2+外,还可能含有的金属阳离子有_______________;
(3)步骤③中NaOH参加反应的离子方程式是________________,鼓入空气并充分搅拌的目的是_____________________。
(4)在工业生产中,步骤④通入过量CO2而不加入盐酸的原因是___________;写出步骤④通入过量CO2的离子方程式 _________________________________。
(5)试设计实验证明榴石矿中含有FeO(试剂任选,说明实验操作与现象)_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为蒸馏实验装置。
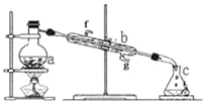
(1)写出下列仪器的名称:a.__b.__。
(2)实验过程中,需要通冷水,图中的进水方向是__进(填图中字母)。
(3)若利用装置分离四氯化碳和酒精的混合物,还缺少的用品是__。
(4)若用装置制蒸馏水,实验时a中除加入少量自来水外,还需加入少量__,其作用是防止暴沸。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
四 | ⑨ | ⑩ |
(1)在这些元素中,最易失电子的元素是________,非金属性最强的元素是______;
(2)化学性质最不活泼的元素是_____,其原子的原子结构示意图为________;
(3)元素的最高价氧化物对应的水化物中酸性最强的是____,碱性最强的是___,呈两性的氢氧化物是_______________;(填写化学式)
(4)在③~⑦元素中,简单离子半径最小的是_________;
(5在⑦与⑩的单质中,氧化性较强的是_______________,用反应化学方程式证明:_____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com