
【题目】(1)基态Ga原子中能量最高的能层符号________ 有______ 种不同能量的电子,Ga元素与同周期相邻元素Zn、Ge相比,第一电离能从大到小的顺序__________,(用元素符号表示)金属Zn晶体采用六方最密堆积,其密置层堆积方式为__________ (ABABAB或ABCABC)区分晶体和非晶体最可靠的科学方法是________________。
(2)磷有三种含氧酸 H3PO2 、 H3PO3 、 H3PO4 其中磷原子均以sp3杂化与相邻原子形成四个α 键,则①H3PO3的结构式是__________;②写出H3PO2 与足量强氧化钠溶液反应的化学方程式_________;③三种酸的强弱顺序为H3PO2 <H3PO3 < H3PO4,其原因是___________;④HNO3 、 HNO2 中心原子的杂化方式分别为__________。
(3)金属铜投入氨水或过氧化氢溶液中均无明显现象,但投入氨水和过氧化氢的混合溶液中,则铜片溶解,溶液呈深蓝色。①写出该反应的离子反应方程式____________________________ ;②已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,原因是_______________。
【答案】 N 8 Zn>Ge>Ga ABABAB X射线衍射实验 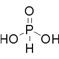 NaOH+H3PO2=NaH2PO2+H2O H3PO2 、 H3PO3 、 H3PO4 中磷元素的化合价依次为+1、+3、+5,中心磷原子的正电荷依次升高,导致P-O-H中氧原子的电子更易向磷原子偏移,因而更易电离出氢离子,酸性越来越强 sp2 Cu + 4NH3H2O +H2O2 = [Cu(NH3)4]2+ +2OH- + 4H2O (或Cu + 4NH3 +H2O2 = [Cu(NH3)4]2+ +2OH-) F的电负性比N大,N-F成键电子对向F偏移,导致NF3中N原子对其孤对电子吸引能力强,难以形成配位键
NaOH+H3PO2=NaH2PO2+H2O H3PO2 、 H3PO3 、 H3PO4 中磷元素的化合价依次为+1、+3、+5,中心磷原子的正电荷依次升高,导致P-O-H中氧原子的电子更易向磷原子偏移,因而更易电离出氢离子,酸性越来越强 sp2 Cu + 4NH3H2O +H2O2 = [Cu(NH3)4]2+ +2OH- + 4H2O (或Cu + 4NH3 +H2O2 = [Cu(NH3)4]2+ +2OH-) F的电负性比N大,N-F成键电子对向F偏移,导致NF3中N原子对其孤对电子吸引能力强,难以形成配位键
【解析】分析:了解核外电子的运动状态及其排布规律,了解第一电离能的变化规律,了解晶体中结构粒子的堆积方式,根据中心原子的杂化类型判断分子的结构,根据分子结构判断键的极性强弱,根据价层电子对互斥理论判断中心原子的杂化类型。
详解:(1)基态Ga原子的价电子排布式为4s24p1,故其能量最高的能层符号N ;基态Ga原子共有1s、2s、2p、3s、3p、3d、4s、4p等8种能级,故有8种不同能量的电子。同一周期的第一电离能呈逐渐增大的趋势,由于Zn的价电子排布处于全充满状态,故其第一离能高于邻近的两种元素,所以,Ga元素与同周期相邻元素Zn、Ge相比,第一电离能从大到小的顺序Zn>Ge>Ga,金属Zn晶体采用六方最密堆积,其密置层堆积方式为ABABAB,区分晶体和非晶体最可靠的科学方法是X射线衍射实验。
(2)磷有三种含氧酸 H3PO2 、 H3PO3 、 H3PO4 ,其中心原子磷原子的价层电子对数均为4(![]() ),故磷原子均以sp3杂化与相邻原子形成四个α 键,则①H3PO3的结构式是
),故磷原子均以sp3杂化与相邻原子形成四个α 键,则①H3PO3的结构式是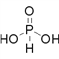 ;②H3PO2是一元酸,其与足量强氧化钠溶液反应的化学方程式为NaOH+H3PO2=NaH2PO2+H2O,③三种酸的强弱顺序为H3PO2<H3PO3<H3PO4,其原因是:H3PO2 、 H3PO3 、 H3PO4 中磷元素的化合价依次为+1、+3、+5,中心磷原子的正电荷依次升高,导致P-O-H中氧原子的电子更易向磷原子偏移,O-H键的极性更强,因而更易电离出氢离子,酸性越来越强;④HNO3 、 HNO2 中心原子的价层电子对数均为
;②H3PO2是一元酸,其与足量强氧化钠溶液反应的化学方程式为NaOH+H3PO2=NaH2PO2+H2O,③三种酸的强弱顺序为H3PO2<H3PO3<H3PO4,其原因是:H3PO2 、 H3PO3 、 H3PO4 中磷元素的化合价依次为+1、+3、+5,中心磷原子的正电荷依次升高,导致P-O-H中氧原子的电子更易向磷原子偏移,O-H键的极性更强,因而更易电离出氢离子,酸性越来越强;④HNO3 、 HNO2 中心原子的价层电子对数均为![]() 3,故其杂化方式均为sp2。
3,故其杂化方式均为sp2。
(3)金属铜投入氨水或过氧化氢溶液中均无明显现象,但投入氨水和过氧化氢的混合溶液中,则铜片溶解,溶液呈深蓝色,说明铜、氨水、过氧化氢能反应生成[Cu(NH3)4]2+,①该反应的离子反应方程式为Cu + 4NH3H2O +H2O2 = [Cu(NH3)4]2+ +2OH- + 4H2O(或Cu + 4NH3 +H2O2 = [Cu(NH3)4]2+ +2OH-) ,②已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,原因是:F的电负性比N大,N-F成键电子对向F偏移,导致NF3中N原子对其孤对电子吸引能力强,难以形成配位键。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】如图所示装置在化学实验中用途广泛,气体b进a出时能实现下列目的的是
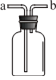
A. 利用排空气法收集NO气体
B. 集气瓶中装满饱和氯化钠溶液收集Cl2
C. 在集气瓶中加入浓硫酸干燥SO2气体
D. 利用排空气法收集CO2气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3===K2O+5Na2O+16N2↑下列说法正确的是:
A. KNO3是还原剂,其中氮元素被氧化
B. 生成物中的N2是氧化产物,K2O是还原产物
C. 每转移1 mol电子,可生成标准状况下N2的体积为35.84 L
D. 若有65 g NaN3参加反应,则被氧化的N的物质的量为3.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合金相对于金属单质具有许多优良的物理、化学与机械性能。下列有关合金的叙述错误的是
A.目前我国使用量最大的合金是铝合金B.我国最早使用的合金是青铜
C.合金的熔点一般比其成分金属的熔点低D.合金中也可能含有非金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两份体积相同的某植物营养液,其配方分别如下:
KCl | K2SO4 | ZnSO4 | |
① | 0.3 mol·L-1 | 0.2 mol·L-1 | 0.1 mol·L-1 |
② | 0.1 mol·L-1 | 0.3 mol·L-1 | — |
下列对这两份营养液成分的分析中正确的是( )
A. K+的物质的量相同
B. Cl-的物质的量相同
C. 完全相同
D. SO![]() 的物质的量不同
的物质的量不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。

根据判断出的元素回答问题:
上述元素可组成盐R:zx4f(gd4)2。向盛有10mL 1mol·L-1R溶液的烧杯中滴加1mol·L-1NaOH溶液,沉淀物质的量随NaOH溶液体积的变化示意图如下:

(1)R溶液中,离子浓度由大到小的顺序是___________________________________
(2)写出m点反应的离子方程式:__________________________________________。
(3)若在R溶液中改加20mL 1.2mol·L-1 Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为________ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】网络趣味图片“一脸辛酸”,是在人脸上重复画满了辛酸的键线式结构(如图)。在辛酸的同分异构体中, 含有一个“-COOH”和三个“-CH3”的结构(不考虑立体异构),除![]() 外,还有( )
外,还有( )
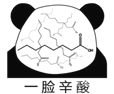
A. 7种 B. 11种 C. 14种 D. 17种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成氨的反应为N2(g)+3H2(g)![]() 2NH3(g)是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1 mol H—H键、1 mol N—H键、1 mol N≡N键放出的能量分别为436 kJ、391 kJ、946 kJ。则:
2NH3(g)是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1 mol H—H键、1 mol N—H键、1 mol N≡N键放出的能量分别为436 kJ、391 kJ、946 kJ。则:
(1)若1 mol氮气完全反应生成氨气可放出的能量为________ kJ。
(2)如果将1 mol氮气和3 mol氢气混合,使充分反应,反应放出的能量总小于上述数值,为什么___________?
(3)实验室模拟工业合成氨时,在容积为2 L的密闭容器内,反应经过10分钟后,生成10 mol 氨气,则用氮气表示的化学反应速率是________ mol·L-1·min-1。
(4)一定条件下,当合成氨的反应达到化学平衡时,下列说法正确的是________。
a.正反应速率和逆反应速率相等
b.正反应速率最大,逆反应速率为0
c.氮气的转化率达到最大值
d.氮气和氢气的浓度相等
e.N2、H2和NH3的体积分数相等
f.反应达到最大程度
(5)根据题目所给条件,判断影响该反应速率的因素有________、________、__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型净水剂高铁酸钾(K2FeO4)为暗紫色固体,可溶于水,在中性或酸性溶液中逐渐分解,在碱性溶液中稳定。工业上制备K2FeO4的常用方法有两种。
方法Ⅰ:次氯酸盐氧化法。工艺流程如图所示。
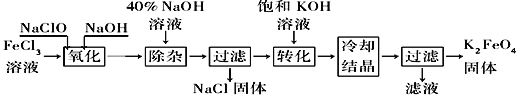
(1)完成“氧化”过程中反应的化学方程式:______FeCl3+______NaOH+______NaClO==______Na2FeO4+______![]() +______
+______![]() 。____________其中氧化剂是________(填化学式)。
。____________其中氧化剂是________(填化学式)。
(2)“转化”过程中发生反应的化学方程式为____________________________________。
(3)上述工艺得到的高铁酸钾常含有杂质,可用重结晶法提纯,操作是将粗产品用________________溶解,然后________________。
方法Ⅱ:电解法。以铁为阳极电解氢氧化钠溶液,然后在阳极液中加入KOH。
(4)电解时阳极发生反应生成FeO42-,该电极反应方程式为________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com