
【题目】两份体积相同的某植物营养液,其配方分别如下:
KCl | K2SO4 | ZnSO4 | |
① | 0.3 mol·L-1 | 0.2 mol·L-1 | 0.1 mol·L-1 |
② | 0.1 mol·L-1 | 0.3 mol·L-1 | — |
下列对这两份营养液成分的分析中正确的是( )
A. K+的物质的量相同
B. Cl-的物质的量相同
C. 完全相同
D. SO![]() 的物质的量不同
的物质的量不同
【答案】A
【解析】
试题A、营养液①中c(K+)=c(KCl)+2c(K2SO4)=0.3mol/L+2×0.2mol/L=0.7mol/L,营养液②中c(K+)=c(KCl)+2c(K2SO4)=0.1mol/L+2×0.3mol/L=0.7mol/L,钾离子浓度相同,溶液体积相同,K+的物质的量相同,A正确;B、营养液①中c(Cl-)=c(KCl)=0.3mol/L,营养液②中c(Cl-)=c(KCl)=0.1mol/L,氯离子浓度不同,溶液体积相同,Cl-的物质的量不同,B错误;C、营养液①中含有锌离子,营养液②中不含锌离子,两份营养液成分不相同,C错误;D、营养液①中c(SO42-)=c(K2SO4)+c(ZnSO4)=0.2mol/L+0.1mol/L=0.3mol/L,营养液②中c(SO42-)=c(K2SO4)=0.3mol/L,SO42-浓度相同,溶液体积相同,SO42-的物质的量相同,D错误;故选A。


 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:
【题目】如图为两种途径制备硫酸的过程(反应条件略),下列说法不正确的是( )

A. 途径②增大O2浓度可提高SO2转化率
B. 含l mol H2SO4的浓溶液与足量NaOH反应,放出的热量即为中和热
C. 途径②中SO2和SO3均属于酸性氧化物
D. 若△Hl<△H2+△H3,则2H2O2(aq)=2H2O(1) +O2(g)为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某模拟“人工树叶”电化学实验装置如右图所示,该装置能将H2O和CO2转化为O2和C3H8O。下列说法错误的是( )
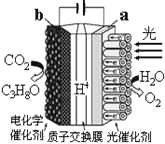
A. 该装置将光能和电能转化为化学能
B. 该装置工作时,H+从a极区向b极区迁移
C. 每还原44 g CO2,理论上可生成33.6L O2
D. b电极的反应为:3CO2+18H++18e-=C3H8O+5H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]
氯吡格雷(clopidogrel,1)是一种用于抑制血小板聚集的药物,根据原料的不同,该药物的合成路线通常有两条,其中以2—氯苯甲醛为原料的合成路线如下:

(1)X(C6H7BrS)的结构简式为 。
(2)写出C聚合成高分子化合物的化学反应方程式 。(不需要写反应条件)
(3)已知:①  ②
②![]() 中氯原子较难水解,物质A(
中氯原子较难水解,物质A(![]() )可由2—氯甲苯为原料制得,写出以两步制备A的化学方程式___________________。
)可由2—氯甲苯为原料制得,写出以两步制备A的化学方程式___________________。
(4)物质G是物质A的同系物,比A多一个碳原子。符合以下条件的G的同分异构体共有 种。
①除苯环之外无其它环状结构;②能发生银镜反应
(5)已知:![]()
写出由乙烯、甲醇为有机原料制备化合物![]() 的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分类合理的是( )
A.氧化物:CO2 , NO,SO2 , H2O
B.碱:NaOH,KOH,Ba(OH)2 , Na2CO3
C.铵盐:NH4Cl,NH4NO3 , (NH4)2SO4 , NH3H2O
D.碱性氧化物:Na2O,CaO,Mn2O7 , Al2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学化学常见的有机化合物A(C6H6O)是重要的化工原料,在工业上能合成紫外线吸收剂BAD和治疗心脏病药物的中间体F,合成路线如下:
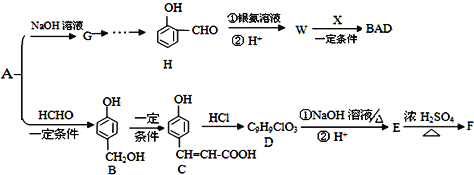
已知:BAD的结构简式为: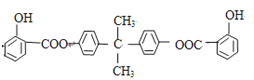
F的结构简式为: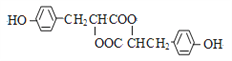
试回答:
(1)H中含有的官能团名称是____________________。
(2)写出X的结构简式____________________________________,推测B的核磁共振氢谱中显示有__________种不同化学环境的氢原子。
(3)写出反应类型A→B______________;W→BAD______________。
(4)1mol C可以和______________mol Br2反应。
(5)C→D的过程中可能有另一种产物C1,请写出在加热条件下C1与足量稀NaOH水溶液反应的化学方程式:__________________________。
(6)B与HCHO在一定条件下反应生成高分子化合物的原理,与酚醛树脂的制备原理相似。请写出该反应的化学方程式___________________。
(7)W的同分异构体有多种,写出所有符合以下要求的W的同分异构体:________________。
①与FeCl3溶液反应,溶液呈紫色; ②能发生银镜反应;③苯环上的一氯代物只有两种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组研究溶液中Fe2+的稳定性,进行如下实验,记录结果。
【实验Ⅰ】
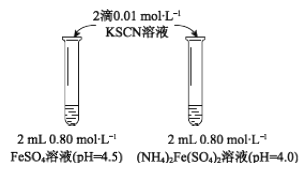
物质 | 0 min | 1min | 1h | 5h |
FeSO4 | 淡黄色 | 桔红色 | 红色 | 深红色 |
((NH4)2Fe(SO4)2 | 几乎无色 | 淡黄色 | 黄色 | 桔红色 |
(1)上述(NH4)2Fe(SO4)2溶液pH小于FeSO4的原因是_____________(用离子方程式表示)。溶液的稳定性:FeSO4_______(NH4)2Fe(SO4)2(填“>”或“<”)。
(2)甲同学提出实验Ⅰ中两溶液的稳定性差异可能是(NH4)2Fe(SO4)2溶液中的NH4+保护了Fe2+,因为NH4+具有还原性。进行【实验Ⅱ】,否定了该观点,请补全该实验。
操作 | 现象 |
取__________,滴加_______,观察。 | 与实验Ⅰ中(NH4)2Fe(SO4)2溶液现象相同。 |
(3)乙同学提出【实验Ⅰ】中两溶液的稳定性差异是溶液酸性不同导致,进行【实验III】,分别配制0.8 mol![]() L—pH为1、2、3、4的FeSO4溶液,观察,发现pH=1的FeSO4溶液长时间无明显变化,pH越大,FeSO4溶液变黄的时间越短。
L—pH为1、2、3、4的FeSO4溶液,观察,发现pH=1的FeSO4溶液长时间无明显变化,pH越大,FeSO4溶液变黄的时间越短。
资料显示:亚铁盐溶液中存在反应4Fe2++O2+10H2O ![]() 4Fe(OH)3+8H+
4Fe(OH)3+8H+
由【实验III】,乙同学可得出实验的结论是___________________________,原因是___________________________________________________________。
(4)进一步研究在水溶液中
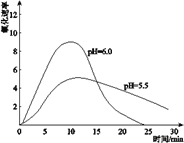
(5)综合以上实验,增强Fe2+稳定性的措施有__________________________。
(6)向溶液中加入一定量H2O2氧化Fe2+。为确定加入H2O2的量,需先用K2Cr2O7标准溶液滴定滤液中的Fe2+,离子方程式如下:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
①在向滴定管注入K2Cr2O7标准溶液前,滴定管需要检漏、用蒸馏水洗涤和_____________________,应选用___________式滴定管。
②若滴定xmL滤液中的Fe2+,消耗amol·L—1K2Cr2O7标准溶液bmL,则滤液中c(Fe2+)=______mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是

A. a先通入CO2,然后b通入NH3,c中放碱石灰
B. a先通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
C. b先通入NH3,然后a通入CO2,c中放碱石灰
D. b先通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于1.5mol氢气的叙述错误的是( )
A.体积是33.6LB.质量是3g
C.所含电子的物质的量是3molD.氢原子数目约为3×6.02×1023个
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com