
【题目】某模拟“人工树叶”电化学实验装置如右图所示,该装置能将H2O和CO2转化为O2和C3H8O。下列说法错误的是( )
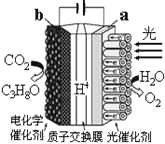
A. 该装置将光能和电能转化为化学能
B. 该装置工作时,H+从a极区向b极区迁移
C. 每还原44 g CO2,理论上可生成33.6L O2
D. b电极的反应为:3CO2+18H++18e-=C3H8O+5H2O
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】铜与浓硫酸反应后试管底部有白色固体并有少量黑色物质。倒去上层浓硫酸,将剩余固体(含少量硫酸)倒入盛水的烧杯中,所得溶液为蓝色,仍有黑色固体未溶。试回答:
(1)原试管底部的白色固体是________,形成白色固体的原因是_________________________。
(2)黑色固体可能是CuO吗?说明理由:___________________________________。
(3)资料显示,CuS、Cu2S为黑色固体,CuS、Cu2S都能被硝酸氧化为Cu2+和SO![]() ,都能在空气中灼烧生成CuO和SO2。
,都能在空气中灼烧生成CuO和SO2。
①写出CuS溶于浓硝酸的化学方程式:_________________________。
②将烧杯中黑色固体过滤并洗涤干净,加入少量浓硝酸,待固体溶解后再加入少量BaCl2溶液。该实验过程中,能说明黑色固体中含Cu、S两种元素的实验现象是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三种液态混合物:①乙酸(沸点118℃)和乙酸乙酯(沸点77.1℃);②汽油和水③溴水.在实验室分离这三种混合物的正确方法依次为( )
A.蒸馏、分液、萃取
B.萃取、蒸馏、分液
C.分液、蒸馏、萃取
D.蒸馏、萃取、分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制2mol/L的NaCl溶液950mL时应选用的容量瓶的规格和NaCl质量分别是( )
A.950mL 111.2g
B.1000mL 117g
C.1000mL 111.2g
D.950mL 117g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X中可能含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32﹣、SO32﹣、SO42﹣、Cl﹣、NO3﹣中的一种或几种,取该溶液进行连续实验,实验过程如下:

根据以上信息,回答下列问题:
(1)仅根据上述连续实验不能确定溶液X中是否含有的阳、阴离子分别是 .能证明该阴离子是否存在的简单实验操作为____ __.
(2)用离子方程表达下列反应:
①中生成气体A: .②中生成溶液H: .
(3)若②中所用氢氧化钠浓度为2mol/L,当加入l0ml时开始产生沉淀,55ml时沉淀的量达到最大值0.03mol,继续滴加沉淀的量保持不变,随后再滴加沉淀部分溶解,到60ml时沉淀的量降为0.025mol且保持不变,则原溶液中c(Fe2+)为 mol/L、c(Fe3+)为 mol/L、c(Cl﹣)为 mol/L.(若有些离子不存在,请填0mol/L)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式表达正确的是
A. 硫酸亚铁酸性溶液中加入过氧化氢:2Fe2++ H2O2 +2H+= 2Fe3++2H2O
B. 用食醋除水垢:CaCO3+2H+=Ca2++CO2↑+H2O
C. 向NaClO溶液中通入少量SO2: 2C1O-+SO2+H2O=SO32-+2HClO
D. Na2S溶于水呈碱性:S2-+ 2H2O![]() H2S +2OH-
H2S +2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(15分)
A、B、C、D都是中学化学中的常见化合物,均由周期表前18号元素组成,D为红综色气体,甲、乙则是两种单质,以上单质和化合物之间在如图1所示的反应关系(反应物和生成物均无省略)。
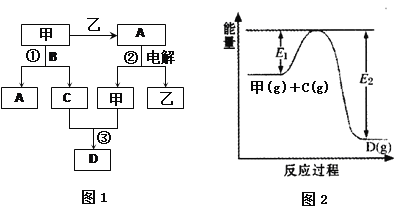
请回答下列问题:
(1)图1所示转化过程中包含的反应类型有 (填字母)。
a.置换反应 b.复分解反应 c.分解反应 d.化合反应
(2)图1中反应①的化学方程式是 。(3分)
(3)图1中反应③在一定条件下为可逆反应,反应的能量变化如图2所示,当该反应处于平衡状态时,下列措施中有利于提高C的平衡转化率的是 (填字母)。
A.升高温度 B.降低温度 C.增大压强
D.减小压强 E.加入催化剂 F.增加C的量
(4)若将l.00 mol甲和2.00 mol C混合充入容积为2 L的密闭容器中,3分钟后反应达到平衡。平衡后混合气体总物质的量为2.55mol,用甲表示的化学反应速率为
molL-1min-1。
(5)容积均为2 L的四个密闭容器中均进行着(4)中的反应,某温度下,各物质物质的量(mol)及正逆反应速率关系如下表所示:
容器编号 | n(甲) | n(C) | n (D) | v正与v逆的关系 |
Ⅰ | 0.20 | 0.10 | 0.20 | v正=v逆 |
Ⅱ | 0.20 | 0.40 | 1.00 | ②? |
Ⅲ | 0.60 | 1.20 | 0.80 | ③? |
①若方程式系数为最简整数比,则该温度下的平衡常数K=
填写表中空格: ② ③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两份体积相同的某植物营养液,其配方分别如下:
KCl | K2SO4 | ZnSO4 | |
① | 0.3 mol·L-1 | 0.2 mol·L-1 | 0.1 mol·L-1 |
② | 0.1 mol·L-1 | 0.3 mol·L-1 | — |
下列对这两份营养液成分的分析中正确的是( )
A. K+的物质的量相同
B. Cl-的物质的量相同
C. 完全相同
D. SO![]() 的物质的量不同
的物质的量不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁是四种短周期元素,乙原子中K层与M层电子数相等;甲原子的核外电子数比乙原子核外电子数少1;丙原子的最外层电子数是次外层电子数的2倍;丁原子核电荷数比丙原子核电荷数多2。请回答:
(1)甲的单质与水反应的离子方程式为__________________。
(2)乙元素在周期表中的位置为__________________。
(3)丙元素的最高价氧化物的电子式为__________________。
(4)甲与丁两种元素可组成的具有强氧化性的物质是__________(填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com