
【题目】某铁的氧化物(FexO)1.52 g溶于足量盐酸中,向所得溶液中通入标准状况下112 mL Cl2,恰好将Fe2+完全氧化。下列说法正确的是( )
A. FexO溶于足量盐酸后只生成了FeCl3和H2O
B. 标准状况下112 mL Cl2的物质的量是5 mol
C. x=0.8
D. 通入Cl2后,发生反应的离子方程式:Fe2++Cl2![]() Fe3++2Cl﹣
Fe3++2Cl﹣
【答案】C
【解析】
A.某铁的氧化物(FexO)1.52g溶于足量盐酸中,再通入氯气,将Fe2+完全氧化生成Fe3+,所以FexO溶于HCl有FeCl2生成,故A错误;
B.标准状况下,氯气的物质的量是0.112L÷22.4L/mol=0.005mol,故B错误;
C.FexO中Fe的平均化合价为+2/x,被氧化为Fe3+,根据电子守恒可知,转移的电子数和Cl2转移的电子数相等。标准状况下112mLCl2转移电子数为0.005mol×2=0.01mol。则有:1.52g/(56x+16)g·mol-1×(3-2/x)×x=0.01mol,解得x=0.8,故C正确;
D.通入Cl2后,发生反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-,故D错误。
故答案选C。


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:
【题目】前四周期原子序数依次增大的元素A、B、C、D、E中,A的基态原子核外3个能级上有电子,且每个能级上的电子数相等,B原子核外电子有7种不同的运动状态,C元素原子核外的M层中只有2对成对电子,D+与C2-的电子数相等,E元素位于元素周期表的ds区,且基态原子价电层电子均已成对。
回答下列问题:
(1)E2+的外围电子排布图为________________。
(2)五种元素中电负性最小的是________(填元素符号),CAB-离子中,A原子的杂化方式是________。
(3)AB-、D+和E2+三种离子组成的化学物质D2E(AB)4,该化合物中存在一个复杂离子,该离子的化学式为________,配位体是________。
(4)C和E两种元素组成的一种化合物的晶胞如图所示。
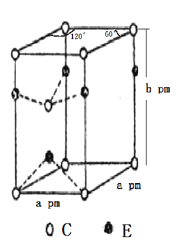
①该化合物的化学式为________,E的配位数为________,C采取________(填“简单立方”、“体心立方”、“六方最密”或“面心立方最密”)堆积;
②列式表示该晶体的密度:________g·cm-3。(NA表示阿伏加德罗常数的值)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外活动小组从实验室取出硫酸试剂,试剂瓶上标签的部分内容如图所示。该小组欲配制450 mL 0.2 mol·L-1的稀H2SO4溶液:

(1)所需试剂瓶内硫酸溶液的体积为________mL。
(2)所用量筒和容量瓶的规格为________和________。
(3)浓硫酸稀释时的操作是________________________。
(4)下列为该小组的操作,可能导致配制溶液浓度偏高的是________。
A.移液前未冷却至室温
B.定容时加水多了,用滴管吸出
C.定容时俯视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】榴石矿石可以看作CaO、FeO、Fe2O3、Al2O3、SiO2组成。工业上对其进行综合利用的流程如下:
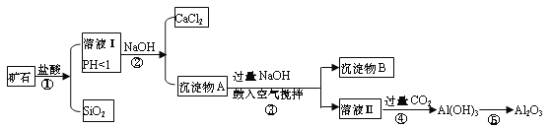
(1)用方程式表示盛放氢氧化钠溶液的试剂瓶不能用玻璃塞的原因________;
(2)溶液Ⅰ中除了Ca2+外,还可能含有的金属阳离子有_______________;
(3)步骤③中NaOH参加反应的离子方程式是________________,鼓入空气并充分搅拌的目的是_____________________。
(4)在工业生产中,步骤④通入过量CO2而不加入盐酸的原因是___________;写出步骤④通入过量CO2的离子方程式 _________________________________。
(5)试设计实验证明榴石矿中含有FeO(试剂任选,说明实验操作与现象)_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为蒸馏实验装置。
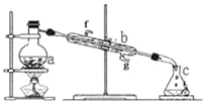
(1)写出下列仪器的名称:a.__b.__。
(2)实验过程中,需要通冷水,图中的进水方向是__进(填图中字母)。
(3)若利用装置分离四氯化碳和酒精的混合物,还缺少的用品是__。
(4)若用装置制蒸馏水,实验时a中除加入少量自来水外,还需加入少量__,其作用是防止暴沸。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案设计中,可行的是( )
A. 加稀盐酸后过滤,除去混在铜粉中的少量镁粉和铝粉
B. 用萃取的方法分离汽油和煤油
C. 用溶解、过滤的方法分离KNO3和 NaCl固体的混合物
D. 将氧气和氢气的混合气体通过灼热的氧化铜,以除去其中的氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:一个碳原子上连多个羟基时不稳定:
芳香烃A有如图的转化关系:
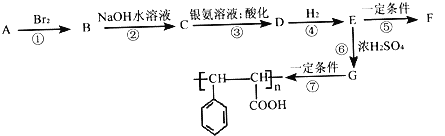
(1)已知1molA能与2molBr2加成,写出A的结构简式___________________;写出B的分子式___________________。
(2)D中含氧官能团的名称为______________,指出反应⑥的反应类型:___________________。
(3)写出C与银氨溶液反应的化学方程式:_________________________________。
(4)E有多种同分异构体,符号下列条件的共有__________种。
①属于芳香化合物; ②能使FeCl3溶液发生显色反应;
③含有酯的结构; ④苯环上有两个取代基。
其中核磁共振氢谱中有6组吸收峰,其面积之比为1∶2∶2∶2∶2∶1的有机物结构简式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷在加热条件下可还原氧化铜,气体产物除水蒸气外,还有碳的氧化物。某化学小组利用如图装置探究其反应产物。

[查阅资料]
①CO能与银氨溶液反应:CO+2[Ag(NH3)2]++2OH-===2Ag↓+2NH4++CO32-+2NH3
②Cu2O为红色,不与Ag+反应,能发生反应:Cu2O+2H+=Cu2++Cu+H2O
(1)装置A中反应的化学方程式为________________________________________。
(2)按气流方向各装置从左到右的连接顺序为A→____________。(填字母编号,装置不重复使用)
(3)实验中滴加稀盐酸的操作为____________________________________。
(4)已知气体产物中含有CO,则装置C中可观察到的现象是____________________;装置F的作用为_____________________。
(5)当反应结束后,装置D处试管中固体全部变为红色。
①设计实验证明红色固体中含有Cu2O:___________________________________________。
②为了证明红色固体中是否含有Cu,甲同学设计如下实验:向少量红色固体中加入适量0.1mol/L AgNO3溶液,发现溶液变蓝,据此判断红色固体中含有Cu。乙同学认为该方案不合理,欲证明甲同学的结论,还需增加如下对比实验,完成表中内容。
实验步骤(不要求写出具体操作过程) | 预期现象和结论 |
______________ | 若观察到溶液不变蓝,则证明红色固体中含有Cu;若观察到溶液变蓝,则不能证明红色固体中含有Cu |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com