
【题目】前四周期原子序数依次增大的元素A、B、C、D、E中,A的基态原子核外3个能级上有电子,且每个能级上的电子数相等,B原子核外电子有7种不同的运动状态,C元素原子核外的M层中只有2对成对电子,D+与C2-的电子数相等,E元素位于元素周期表的ds区,且基态原子价电层电子均已成对。
回答下列问题:
(1)E2+的外围电子排布图为________________。
(2)五种元素中电负性最小的是________(填元素符号),CAB-离子中,A原子的杂化方式是________。
(3)AB-、D+和E2+三种离子组成的化学物质D2E(AB)4,该化合物中存在一个复杂离子,该离子的化学式为________,配位体是________。
(4)C和E两种元素组成的一种化合物的晶胞如图所示。
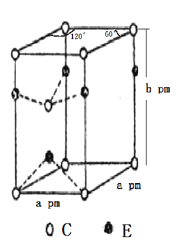
①该化合物的化学式为________,E的配位数为________,C采取________(填“简单立方”、“体心立方”、“六方最密”或“面心立方最密”)堆积;
②列式表示该晶体的密度:________g·cm-3。(NA表示阿伏加德罗常数的值)
【答案】  K sp杂化 [Zn(CN)4]2- CN- ZnS 4 六方最密
K sp杂化 [Zn(CN)4]2- CN- ZnS 4 六方最密 ![]()
【解析】前四周期原子序数依次增大的元素A、B、C、D、E中,A的基态原子核外3个能级上有电子,且每个能级上的电子数相等,则A为碳元素;B原子核外电子有7种不同的运动状态,则B为氮元素;C元素原子核外的M层中只有2对成对电子,则C为硫元素;D+与C2-的电子数相等,则D为钾元素;E元素位于元素周期表的ds区,且基态原子价层电子均已成对,则E为锌元素。
(1) E为锌元素,核电荷数为30,核外电子排布1s22s22p63s23p63d104s2;Zn2+的外围电子排布图为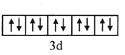 ;正确答案:
;正确答案: 。
。
(2)同一周期,从左到右电负性增大,同一主族,从上到下,电负性减小,因此C、N、 S、K、Zn中,钾的原子半径最大,电负性最小;杂化轨道数=中心原子的孤电子对数+中心原子的σ键个数可知,SCN-中,C与N形成参键,与S形成单键,C原子没有孤电子对,所以C原子的杂化方式是sp杂化;正确答案:K;sp杂化。
(3) K2Zn(CN)4为配合物,在这个配合物中化学键的类型有共价键、配位键、离子键;该化合物中存在配合离子的化学式为[Zn(CN)4]2- ,配位体是CN-;正确答案: [Zn(CN)4]2-;CN-。
(4) 根据晶胞结构图,利用均摊法可以知道,该晶胞中含有S原子数为8×1/8+1=2,Zn原子数为4×1/4+1=2,它们的原子个数比为1:1,所以该化合物的化学式为ZnS,根据晶胞图,以晶胞体内的Zn原子为例,Zn的配位数为4,S采取六方最密堆积;正确答案: ZnS;4;六方最密。
(2)根据晶胞的结构图可以知道,该晶胞的体积为![]() /2a2×10-20×b×10-10=
/2a2×10-20×b×10-10=![]() /2a2b×10-30cm3,所以晶体的密度为
/2a2b×10-30cm3,所以晶体的密度为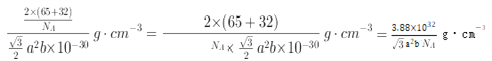 ;正确答案:
;正确答案: ![]() 。
。


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:
【题目】CO2的的资源化利用是解决温室效应的重要途径。以下是在一定条件下用NH3捕获CO2生成重要化工产品三聚氰胺的反应:NH3+CO2→ +H2O。下列有关三聚氰胺的说法正确的是
+H2O。下列有关三聚氰胺的说法正确的是
A. C、N、O原子采用相同的杂化方式 B. 分子中所有原子一定共平面
C. 分子式为C3H3N3O3 D. 生成该物质的上述反应为中和反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中第三周期包括Na、Mg、Al、Si、P、S、Cl、Ar 8种元素。请回答下列问题:
(1)基态磷原子核外有________种运动状态不同的电子。
(2)第三周期8种元素按单质熔点(℃)大小顺序绘制的柱形图(已知柱形“1”代表Ar)如下所示,则其中“2”原子的结构示意图为________,“8”单质晶体的类型为________。


(3)氢化镁
储氢材料的晶胞结构如图所示,已知该晶体的密度为ρ g·cm-3,则该晶体的化学式为________,晶胞的体积为________cm3(用ρ、NA表示,其中NA表示阿伏加德罗常数的值)。
(4)实验证明:KCl、MgO、CaO三种晶体的结构与NaCl晶体的结构相似,已知NaCl、KCl、CaO晶体的晶格能数据如下表:
晶体 | NaCl | KCl | CaO |
晶格能/(kJ·mol-1) | 786 | 715 | 3 401 |
则KCl、MgO、CaO三种晶体的熔点从高到低的顺序是________________。其中MgO晶体中一个Mg2+周围和它最近且等距离的Mg2+有________个。
(5)Si、C和O的成键情况如下:
化学键 | C-O | C=O | Si-O | Si=O |
键能/(kJ·mol-1) | 360 | 803 | 464 | 640 |
C和O之间易形成含有双键的CO2分子晶体,而Si和O之间则易形成含有单键的SiO2原子晶体,请结合数据分析其原因:__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3===K2O+5Na2O+16N2↑下列说法正确的是:
A. KNO3是还原剂,其中氮元素被氧化
B. 生成物中的N2是氧化产物,K2O是还原产物
C. 每转移1 mol电子,可生成标准状况下N2的体积为35.84 L
D. 若有65 g NaN3参加反应,则被氧化的N的物质的量为3.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿伏加德罗常数的值为NA,下列结论错误的是 ( )

A. 完全电解2 mol H2O断裂的σ键键数为4NA
B. 标准状况下,11.2 L CO2中含有的π键键数为2NA
C. 60 g SiO2晶体中含有的Si—O键键数为4NA
D. 128 g金属铜中含有如图所示的晶胞数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合金相对于金属单质具有许多优良的物理、化学与机械性能。下列有关合金的叙述错误的是
A.目前我国使用量最大的合金是铝合金B.我国最早使用的合金是青铜
C.合金的熔点一般比其成分金属的熔点低D.合金中也可能含有非金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。

根据判断出的元素回答问题:
上述元素可组成盐R:zx4f(gd4)2。向盛有10mL 1mol·L-1R溶液的烧杯中滴加1mol·L-1NaOH溶液,沉淀物质的量随NaOH溶液体积的变化示意图如下:

(1)R溶液中,离子浓度由大到小的顺序是___________________________________
(2)写出m点反应的离子方程式:__________________________________________。
(3)若在R溶液中改加20mL 1.2mol·L-1 Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为________ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铁的氧化物(FexO)1.52 g溶于足量盐酸中,向所得溶液中通入标准状况下112 mL Cl2,恰好将Fe2+完全氧化。下列说法正确的是( )
A. FexO溶于足量盐酸后只生成了FeCl3和H2O
B. 标准状况下112 mL Cl2的物质的量是5 mol
C. x=0.8
D. 通入Cl2后,发生反应的离子方程式:Fe2++Cl2![]() Fe3++2Cl﹣
Fe3++2Cl﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com