
【题目】下列实验方案设计中,可行的是( )
A. 加稀盐酸后过滤,除去混在铜粉中的少量镁粉和铝粉
B. 用萃取的方法分离汽油和煤油
C. 用溶解、过滤的方法分离KNO3和 NaCl固体的混合物
D. 将氧气和氢气的混合气体通过灼热的氧化铜,以除去其中的氢气
科目:高中化学 来源: 题型:
【题目】在标准状况下,将aLNH3完全溶于水得到VmL氨水,溶液的密度为ρgcm-3,溶质的质量分数为![]() ,溶质的物质的量浓度为c mol/L。下列叙述中正确的是
,溶质的物质的量浓度为c mol/L。下列叙述中正确的是
A. ![]()
B. ![]()
C. 上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5![]()
D. 上述溶液中再加入同体积同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为:c (Cl-)>c(NH4+)>c (OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实中能说明亚硝酸是弱电解质的是( )
A. 用![]() 溶液做导电试验,灯光较暗
溶液做导电试验,灯光较暗
B. ![]() 是共价化合物
是共价化合物
C. 亚硝酸不与氯化钠反应
D. 常温下0.1mol/L亚硝酸溶液的氢离子约为0.01mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、W、Q、R是7种短周期元素,其原子半径及主要化合价如下:
元素代号 | X | Y | Z | M | W | Q | R |
原子半径/nm | 0.186 | 0.143 | 0.104 | 0.099 | 0.070 | 0.066 | 0.032 |
主要化合价 | +1 | +3 | +6,﹣2 | +7,﹣1 | +5,﹣3 | ﹣2 | +1 |
完成下列填空:
(1)上述元素中,金属性最强的在周期表中的位置是________________________________;X、Y、Q各自形成的简单离子中,离子半径由大到小的顺序是_______(填离子符号)。
W和R按原子个数比1﹕4构成的阳离子所含的化学键是____________________。
(2)表中所列4种第三周期元素的最高价氧化物的水化物碱性最弱的是_______(填化学
式),其电离方程式为_____________________________________。
(3)M与Z相比,非金属性较强的是_____________(填元素名称),请从原子结构的角度说明理由_________________________________________________________________。
(4)在稀硫酸中,KMnO4和H2O2能发生氧化还原反应,反应方程式如下:
![]() KMnO4+
KMnO4+![]() H2O2+
H2O2+![]() H2SO4 →
H2SO4 → ![]() K2SO4+
K2SO4+![]() MnSO4+
MnSO4+![]() O2↑+
O2↑+![]() H2O
H2O
请配平,当有0.5 mol H2O2参加此反应,电子转移的个数为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅是信息技术的关键材料,在工业中可利用镁制取硅:2Mg(过量)+SiO2![]() 2MgO+Si,2Mg+Si
2MgO+Si,2Mg+Si![]() Mg2Si(副反应),查资料得:①Mg2Si遇盐酸迅速反应生成SiH4(硅烷);②SiH4在常温下是一种不稳定易分解、易自燃的气体;③Mg在加热时能与CO2、N2反应。
Mg2Si(副反应),查资料得:①Mg2Si遇盐酸迅速反应生成SiH4(硅烷);②SiH4在常温下是一种不稳定易分解、易自燃的气体;③Mg在加热时能与CO2、N2反应。
I.如图是实验室进行Mg与SiO2反应的裝置:
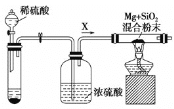
(1)盛放稀硫酸的装置为_________________,由于氧气的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用_________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸。可观察到闪亮的火星,产生此现象的原因用化学方程式表示为 ①____________________; ②_________________。
II.利用如图装置(量气管“0”刻度在刻度线的最上方)可测定生成物的纯度。
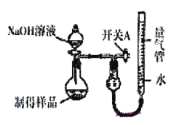
(3)实验开始前应先_________________。
(4)若取样品Wg加入5mLNaOH(足量)充分反应。反应前量气管液面读数为V1mL,反应后为V2mL(实验数据均转化为标准状况下),则样品的纯度为____________________。(写出计算式,不化简)。
(5)若反应结束时读数前未调节量气装置两边液面高度相平(右边的液面高于左边液面),则会导致实验结果______(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将NO2装入带有活塞的密闭容器中,当反应2NO2(g)![]() N2O4(g)达到平衡后,改变下列一个条件,下列叙述正确的是
N2O4(g)达到平衡后,改变下列一个条件,下列叙述正确的是
A. 升高温度,气体颜色加深,则此反应为吸热反应
B. 慢慢压缩气体体积,平衡向正反应方向移动,混合气体的颜色变浅
C. 慢慢压缩气体体积,若体积减小一半,压强增大,但小于原来的两倍
D. 恒温恒容时,充入稀有气体,压强增大,平衡向正反应方向移动,混合气体的颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定质量的AlCl3和MgCl2混合溶液中逐渐滴入一定溶质质量分数的NaOH溶液,生成沉淀的物质的量与加入NaOH的物质的量的关系如图所示,则:
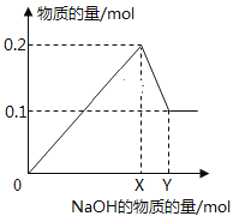
(1)O-X段反应的离子方程式为:________________________,
(2)X-Y段反应的离子方程式为_________________________
(3)生成Mg(OH)2的质量为___________________g;
(4)X=________________;Y=______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下,Fe与水并不发生反应,但在高温下,Fe与水蒸气可发生反应。高温下Fe与水蒸气的反应实验应使用如图所示的装置,在硬质玻璃管中放入铁粉和石棉绒的混合物,通入水蒸气并加热。请回答实验的相关问题。
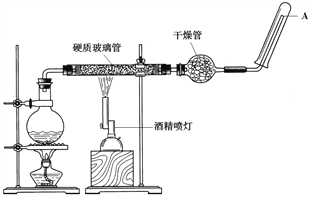
(1)该反应的反应方程式为_________。
(2)圆底烧瓶中装的是水,该装置的主要作用是______________;烧瓶底部放了几片碎瓷片,碎瓷片的作用是________________________。
(3)干燥管中盛装的物质是____________,作用是________________________。
(4)如果要在A处玻璃管口点燃该气体,则必须对该气体进行____________,方法是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com