
����Ŀ��X��Y��Z��M��W��Q��R��7�ֶ�����Ԫ�أ���ԭ�Ӱ뾶����Ҫ���ϼ����£�
Ԫ�ش��� | X | Y | Z | M | W | Q | R |
ԭ�Ӱ뾶/nm | 0.186 | 0.143 | 0.104 | 0.099 | 0.070 | 0.066 | 0.032 |
��Ҫ���ϼ� | +1 | +3 | +6����2 | +7����1 | +5����3 | ��2 | +1 |
���������գ�
��1������Ԫ���У���������ǿ�������ڱ��е�λ����________________________________��X��Y��Q�����γɵļ������������Ӱ뾶�ɴ�С��˳����_______(�����ӷ���)��
W��R��ԭ�Ӹ�����1�s4���ɵ������������Ļ�ѧ����____________________��
��2����������4�ֵ�������Ԫ�ص�����������ˮ���������������_______(�ѧ
ʽ)������뷽��ʽΪ_____________________________________��
��3��M��Z��ȣ��ǽ����Խ�ǿ����_____________����Ԫ�����ƣ������ԭ�ӽṹ�ĽǶ�˵������_________________________________________________________________��
��4����ϡ�����У�KMnO4��H2O2�ܷ���������ԭ��Ӧ����Ӧ����ʽ���£�
![]() KMnO4��
KMnO4��![]() H2O2+
H2O2+![]() H2SO4 ��
H2SO4 �� ![]() K2SO4��
K2SO4��![]() MnSO4��
MnSO4��![]() O2����
O2����![]() H2O
H2O
����ƽ������0.5 mol H2O2�μӴ˷�Ӧ������ת�Ƶĸ���Ϊ______________________��
���𰸡� �������ڢ�A�� O2����Na+��Al3+�� ���ۼ� Al (OH)3 H+ + Al O2��+H2O ![]() Al (OH)3
Al (OH)3![]() Al 3++3OH�� �� ��ԭ������ԭ�ӵ��Ӳ�����ͬ����ԭ���������7�����ӣ���ԭ���������6�����ӣ� �ȵ�ԭ�Ӱ뾶�����ԭ�Ӱ뾶С��ԭ�Ӻ˶������ӵ�����������������ȵķǽ����Ը�ǿ 2KMnO4��5 H2O2+3H2SO4 �� 1 K2SO4��2 MnSO4��5 O2����8 H2O��6.02��1023
Al 3++3OH�� �� ��ԭ������ԭ�ӵ��Ӳ�����ͬ����ԭ���������7�����ӣ���ԭ���������6�����ӣ� �ȵ�ԭ�Ӱ뾶�����ԭ�Ӱ뾶С��ԭ�Ӻ˶������ӵ�����������������ȵķǽ����Ը�ǿ 2KMnO4��5 H2O2+3H2SO4 �� 1 K2SO4��2 MnSO4��5 O2����8 H2O��6.02��1023
��������X��R�Ļ��ϼ۶�Ϊ+1�ۣ�ӦΪ���ڱ��ڢ�A�壬���ݰ뾶��ϵ��֪RΪH��XΪNa��Z��Q�Ļ��ϼ۶���-2�ۣ�ӦΪ���ڱ��ڢ�A��Ԫ�أ�Z�����Ϊ+6�ۣ�ӦΪSԪ�أ�Q�����ۣ�ӦΪOԪ�أ�Y�Ļ��ϼ�Ϊ+3�ۣ�ӦΪ���ڱ��ڢ�A��Ԫ�أ����ݰ뾶����ZС��X��֪Ӧ��Xͬ���ڣ�ΪAlԪ�أ�MΪ+7��-1�ۣ���ԭ�Ӱ뾶С��S����O����MΪClԪ�أ�WΪ+5��-3�ۣ���ԭ�Ӱ뾶С��Cl����O����MΪNԪ�ء���1������Ԫ���У���������ǿ��ΪNa�������ڱ��е�λ���ǵ������ڢ�A�壻X��Y��Q�����γɵļ�����Na+��Al3+��O2-������ͬ���Ӳ�ṹ���˵����Խ��뾶ԽС�������Ӱ뾶�ɴ�С��˳����O2����Na+��Al3+��W��R��ԭ�Ӹ�����1�s4���ɵ�������NH���������Ļ�ѧ���ǹ��ۼ�����2����������4�ֵ�������Ԫ��Na��Al��S��Cl������������ˮ���������������Al (OH)3������뷽��ʽΪH+ + Al O2��+H2O ![]() Al (OH)3
Al (OH)3![]() Al 3++3OH������3��ͬ����Ԫ�ش����ҷǽ��������μ�������Cl��S��ȣ��ǽ����Խ�ǿ������Ԫ�أ���ԭ�ӽṹ�ĽǶ�˵������Ϊ��ԭ������ԭ�ӵ��Ӳ�����ͬ����ԭ���������7�����ӣ���ԭ���������6�����ӣ� �ȵ�ԭ�Ӱ뾶�����ԭ�Ӱ뾶С��ԭ�Ӻ˶������ӵ�����������������ȵķǽ����Ը�ǿ����4����Ӧ��KMnO4���̻��ϼ���+7�۱�Ϊ+2�ۣ�H2O2����Ԫ����-1�۱�Ϊ0�ۣ�ת�Ƶ�����Ϊ5
Al 3++3OH������3��ͬ����Ԫ�ش����ҷǽ��������μ�������Cl��S��ȣ��ǽ����Խ�ǿ������Ԫ�أ���ԭ�ӽṹ�ĽǶ�˵������Ϊ��ԭ������ԭ�ӵ��Ӳ�����ͬ����ԭ���������7�����ӣ���ԭ���������6�����ӣ� �ȵ�ԭ�Ӱ뾶�����ԭ�Ӱ뾶С��ԭ�Ӻ˶������ӵ�����������������ȵķǽ����Ը�ǿ����4����Ӧ��KMnO4���̻��ϼ���+7�۱�Ϊ+2�ۣ�H2O2����Ԫ����-1�۱�Ϊ0�ۣ�ת�Ƶ�����Ϊ5![]() �����������ԭ��Ӧ�������غ���ƽ����Ӧ����ʽ���£�2KMnO4��5 H2O2+3H2SO4 =1 K2SO4��2 MnSO4��5 O2����8 H2O������0.5 mol H2O2�μӴ˷�Ӧ������ת�Ƶĸ���Ϊ0.5 mol
�����������ԭ��Ӧ�������غ���ƽ����Ӧ����ʽ���£�2KMnO4��5 H2O2+3H2SO4 =1 K2SO4��2 MnSO4��5 O2����8 H2O������0.5 mol H2O2�μӴ˷�Ӧ������ת�Ƶĸ���Ϊ0.5 mol![]() =
=![]() =6.02��1023��
=6.02��1023��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Ļ�����������ʵ�飺
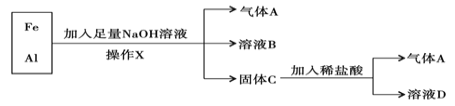
��1������X�������� ��
��2������A�� ���ѧʽ����
��3��A��Cl2��Ϲ��տ��ܷ�����ը������ ���ѧʽ����A�ڸ÷�Ӧ����Ϊ �������������ԭ��������
��4����ҺB�������ӳ�OH- ���________________ �������ӷ���������ҺD�д��ڵĽ�������Ϊ________________________ �������ӷ�������
��5����������NaOH��Һʱ������Ӧ�����ӷ���ʽΪ��_____________________������ϡ���ᷢ����Ӧ�����ӷ���ʽΪ�� ___________________________��
��6������ҺD����NaOH��Һ���۲쵽�����İ�ɫ��״����Ѹ�ٱ�Ϊ����ɫ�����ձ�Ϊ���ɫ����д������ת���Ļ�ѧ����ʽ��_______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪AΪ����ɫ���壬R�ǵؿ��к������Ľ���Ԫ�صĵ��ʣ�TΪ������ʹ����㷺�Ľ������ʣ� C��F����ɫ��ζ�����壬H�ǰ�ɫ��������
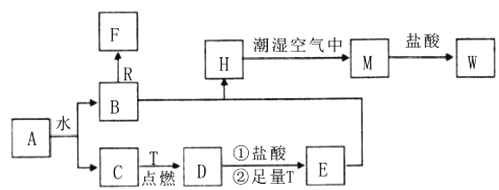
(1)H�ڳ�ʪ�����б��M��ʵ��������______________,��ѧ����ʽΪ________��
(2)A��ˮ��Ӧ����B��C�����ӷ���ʽΪ___________________________,�ɴ˷�Ӧ��֪A����Ϊ_________����;��
(3)����ٵ����ӷ���ʽ_________________________,����ں�����ӷ���ʽ___________________��д������W��Һ����Ҫ����������Ҫ���Լ���_____��
(4)B��R����Һ�з�Ӧ����F�����ӷ���ʽΪ_____________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ѿ�ѧ���Ļ�ѧ֪ʶ���ش��������⡣
I.��1����������ʮ�����ʣ������� ������KNO3 ��ʯī ��ͭ˿ ��NaOH���� ��SO3 ��BaSO4���� ��K2O���� ��Һ̬H2SO4 ��Һ�� ���������пɵ������________������ţ���ͬ�������������в��ܵ��磬�����ڵ���ʵ���_______________________��
��2��NaHSO4��һ����ʽ�Σ�����д���пհף�
��д��NaHSO4��ˮ�еĵ��뷽��ʽ _____________________________________��
����0.1 mol��L-1��NaHSO4��Һ�ĵ���������ͬ����������Һ�����ʵ���Ũ��Ϊ��__________��
��NaHSO4��Һ��NaHCO3��Һ��Ӧ�����ӷ���ʽΪ______________________________��
��3�������к�������CaCl2��MgCl2��һЩ�����Σ���ȥ��Щ���ʵ��Լ���ѡ�ã���Na2CO3����NaOH����BaCl2����HCl������ű�ʾ������Ⱥ�˳��������______________________��
II��A��B��C��X��Ϊ��ѧ�������ʣ�������һ��������������ת����ϵ������������ȥ����
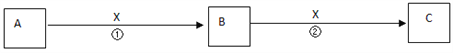
��1����X����������A������ ______������ţ� A��C B��SiC��NaD��Mg
��2����X�ǽ������ʣ���C��ˮ��Һ�е���AgNO3��Һ�������˲�����ϡHNO3�İ�ɫ��������B�Ļ�ѧʽΪ__________��C��Һ������ʱӦ��������X�������ǣ������ӷ���ʽ��ʾ��________________������B��Һ�������ӵIJ���������________________________��
��3����X������������Һ��A��B��C��Ϊ����Ԫ�صĻ������Ӧ�ڵ����ӷ���ʽΪ________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CPAE�Ƿ佺����Ҫ���Գɷ֣���ṹ��ʽ��ͼ��ʾ������˵������ȷ���ǣ� ��

A. CPAE�ܷ���ȡ����Ӧ���ӳɷ�Ӧ
B. CPAE��ʹ���Ը��������Һ��ɫ
C. CPAE��������������Һ������Ӧ
D. CPAE������������ˮ��õ���Է���������С���л����ͬ���칹�干��9��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2017��3��21���ǵڶ�ʮ��조����ˮ�ա�������ˮ��Դ���������÷�ˮ��ʡˮ��Դ����ǿ��ˮ�Ļ��������ѱ�Խ��Խ���������ע����֪��ij��ɫ��ˮ�п��ܺ���H����NH4+��Fe3����Al3����Mg2����Na����NO3����CO32����SO42���еļ��֣�Ϊ������ɷ֣��ֱ�ȡ��ˮ��Ʒ100mL������������ʵ�飬��������й�ͼ��������ʾ��

��ش��������⣺
��1����������3��ʵ����Է�����ˮ��һ�������ڵ���������_________________��һ�����ڵ���������__________________________��
��2��д��ʵ���ͼ���г�����ʼ��������ȫ��ʧ�η�����Ӧ�����ӷ�Ӧ����ʽ��__________________��
��3������ͼ����ԭ��Һ��c(NH4+)��c(Al3��)�ı�ֵΪ______________________�����ó��������������_____________________g��
��4����ͨ��ʵ��ȷ��ԭ��ˮ��c(Na��)=0.14 mol��L1,���ж�ԭ��ˮ��NO3�Ƿ���ڣ�_______������ڡ��������ڡ���ȷ�������� �����ڣ�c(NO3)=___________mol��L1�����������ڻ�ȷ����˿ղ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�鷽������У����е���(����)
A. ��ϡ�������ˣ���ȥ����ͭ���е�����þ�ۺ�����
B. ����ȡ�ķ����������ͺ�ú��
C. ���ܽ⡢���˵ķ�������KNO3�� NaCl����Ļ����
D. �������������Ļ������ͨ�����ȵ�����ͭ���Գ�ȥ���е�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Ӧ�����Ϊ5L�ĺ����ܱ������н��У� ��0-3�����ڸ����ʵ����ı仯�����ͼ��ʾ��A��B��C��Ϊ���壬��A��������ɫ����
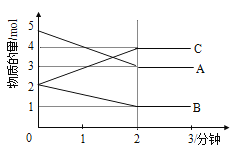
��1���÷�Ӧ�ĵĻ�ѧ����ʽΪ_____________________________��
��2����Ӧ��ʼ��2����ʱ��B��ƽ����Ӧ����Ϊ_________��
��3����˵���÷�Ӧ�Ѵﵽƽ��״̬����___________��
a��v(A)= 2v(B) b�������ڸ����ʵ����ʵ������
c��v��(A)=v��(C) d���������������ɫ���ֲ���
��4����ͼ���ƽ��ʱA��ת����Ϊ_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����Ԫ��A��B��C��D����ԭ����������������������������Ϊ4��1��2��7������AԪ��ԭ�Ӵ���������Ϊ2��B��C ��Ԫ�ص�ԭ�Ӵ���������Ϊ8��BԪ��ԭ�������������ȵ�1���������1��Ҳ��CԪ��ԭ�ӵ�M���������1��DԪ�صĵ���ΪҺ̬�ǽ������ʡ���������Ԫ�ؾ�λ��Ԫ�����ڱ�ǰ�ĸ����ڣ��밴Ҫ����д���и��⣺
��1��Aԭ�ӵ�ԭ�ӽṹʾ��ͼΪ_____��DԪ����Ԫ�����ڱ��е�λ��Ϊ______��
��2��BԪ�ص�����������Ӧ��ˮ�����õ���ʽ��ʾΪ______________��C��D��Ԫ���γɵĻ����ﻯѧ������Ϊ__________��
��3����д��DԪ�صĵ�����SO2ͬʱͨ��ˮ�з�Ӧ�Ļ�ѧ����ʽ��___________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com