
【题目】根据已经学过的化学知识,回答下列问题。
I.(1)现有下列十种物质:①蔗糖 ②熔融KNO3 ③石墨 ④铜丝 ⑤NaOH固体 ⑥SO3 ⑦BaSO4固体 ⑧K2O固体 ⑨液态H2SO4 ⑩液氯 上述物质中可导电的是________(填序号,下同);上述物质中不能导电,但属于电解质的是_______________________。
(2)NaHSO4是一种酸式盐,请填写下列空白:
①写出NaHSO4在水中的电离方程式 _____________________________________。
②与0.1 mol·L-1的NaHSO4溶液的导电能力相同的硫酸钠溶液的物质的量浓度为:__________。
③NaHSO4溶液与NaHCO3溶液反应的离子方程式为______________________________。
(3)粗盐中含可溶性CaCl2、MgCl2及一些硫酸盐,除去这些杂质的试剂可选用,①Na2CO3、②NaOH、③BaCl2、④HCl,用序号表示加入的先后顺序依次是______________________。
II.A、B、C、X均为中学常见物质,它们在一定条件下有如下转化关系(副产物已略去)。
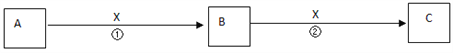
(1)若X是氧气,则A不可能 ______(填序号) A.C B.SiC.NaD.Mg
(2)若X是金属单质,向C的水溶液中滴入AgNO3溶液,产生了不溶于稀HNO3的白色沉淀,则B的化学式为__________;C溶液在贮存时应加入少量X,理由是(用离子方程式表示)________________。检验B溶液中阳离子的操作方法是________________________。
(3)若X是氢氧化钠溶液,A、B、C均为含铝元素的化合物,则反应②的离子方程式为________________。
【答案】②③④ ⑤⑦⑧⑨ NaHSO4 = Na++H++ SO42- 0.1mol/L H++HCO3-= H2O+CO2↑ ②③①④或③②①④ B D FeCl3 2Fe3++Fe═3Fe2+ 取少量B溶液于试管中,滴加少量KSCN溶液,呈血红色 Al(OH)3+OH- =AlO2-+2H2O
【解析】
I.(1)根据物质导电的原因分析,只要含有自由移动的离子或自由电子即可;在水溶液里或熔融状态下能导电的化合物是电解质,包括酸、碱、盐、活泼金属氧化物和水;非电解质是在水溶液里和熔融状态下都不能导电的化合物,包括一些非金属氧化物、氨气、大多数有机物(如蔗糖、酒精等);
(2)①NaHSO4在水中电离出钠离子、氢离子和硫酸根离子;
②溶液导电能力相同说明溶液中离子浓度相同;
③NaHSO4溶液与NaHCO3溶液反应生成硫酸钠、二氧化碳和水;
(3)碳酸钠可除去钙离子及过量的钡离子,NaOH可除去镁离子,氯化钡可除去硫酸根离子,则碳酸钠一定在氯化钡之后,最后加盐酸除去过量的碳酸钠。
II.(1)若X是氧气,由转化关系知,A、B、C中含有的相同元素必须是变价元素;
(2)若X是一种金属单质,X为变价金属,A为强氧化性物质,向C的水溶液中滴入AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则C中含有氯离子,则X为Fe,A为Cl2,符合转化关系,B为FeCl3,C为FeCl2;
(3)若A、B、C均为含铝元素的化合物,X为氢氧化钠,考虑Al的化合物的相互转化, A为铝盐,B为Al(OH)3,C为偏铝酸钠。
I.(1)②熔融的KNO3中有自由移动的离子,所以能导电;③石墨中含有自由移动的电子,所以能导电;④铜丝中有自由电子,所以能导电;⑤NaOH固体、⑦CuSO4固体、⑧K2O固体、⑨液态H2SO4没有自由移动的离子或自由电子,所以不能导电,但属于电解质。本小题答案为:②③④;⑤⑦⑧⑨。
(2)①NaHSO4在水中电离出钠离子、氢离子和硫酸根离子,电离方程式为:: NaHSO4=Na++H++SO42-。本小题答案为:NaHSO4=Na++H++SO42-。
②溶液导电能力相同说明溶液中离子浓度相同,硫酸氢钠电离方程式NaHSO4=Na++H++SO42-,硫酸钠的电离方程式为Na2SO4=2Na++SO42-,与0.1molL1的NaHSO4溶液的导电能力相同的硫酸钠溶液的物质的量浓度也为0.1mol/L。本小题答案为:0.1mol/L。
③NaHSO4溶液与NaHCO3溶液反应生成硫酸钠、二氧化碳和水,反应的离子方程式为:H++HCO3=H2O+CO2↑。本小题答案为:H++HCO3=H2O+CO2↑。
(3)碳酸钠可除去钙离子及过量的钡离子,NaOH可除去镁离子,氯化钡可除去硫酸根离子,则碳酸钠一定在氯化钡之后,最后加盐酸除去过量的碳酸钠,则用序号表示加入的先后顺序是②③①④或③②①④。本小题答案为:②③①④或③②①④。
II.(1)若X是氧气,由转化关系A![]() B
B![]() C进行推导如下:
C进行推导如下:
A.若A为C,C和氧气反应生成一氧化碳,一氧化碳和氧气反应生成二氧化碳,则A符合转化关系;
B.若A为Si,Si和氧气反应生成二氧化硅,二氧化硅和氧气不反应,则B不符合转化关系;
C.若A为Na,Na和氧气反应生成氧化钠,氧化钠和氧气反应生成过氧化钠,则C符合转化关系;
D.若A为Mg,Mg和氧气反应生成氧化镁,氧化镁和氧气不反应,则D不符合转化关系。答案选B、D。
(2)向C的水溶液中滴入AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则C中含有氯离子,若X是一种金属单质,由转化关系A![]() B
B![]() C,X为变价金属铁,A为强氧化性物质,根据元素守恒知,A是氯气,B是氯化铁,C是氯化亚铁;贮存氯化亚铁溶液时,亚铁离子易被氧气氧化生成铁离子,为防止亚铁离子被氧化且不引进新的杂质,应该向氯化亚铁溶液中加入铁粉;亚铁离子和硫氰化钾溶液不反应,铁离子和硫氰化钾溶液混合溶液呈血红色,此现象是铁离子的特征反应,所以检验是否含有铁离子的方法是:向溶液中滴加少量KSCN溶液,溶液呈血红色。本小题答案为:FeCl3;2Fe3++Fe═3Fe2+;取少量B溶液于试管中,滴加少量KSCN溶液,呈血红色。
C,X为变价金属铁,A为强氧化性物质,根据元素守恒知,A是氯气,B是氯化铁,C是氯化亚铁;贮存氯化亚铁溶液时,亚铁离子易被氧气氧化生成铁离子,为防止亚铁离子被氧化且不引进新的杂质,应该向氯化亚铁溶液中加入铁粉;亚铁离子和硫氰化钾溶液不反应,铁离子和硫氰化钾溶液混合溶液呈血红色,此现象是铁离子的特征反应,所以检验是否含有铁离子的方法是:向溶液中滴加少量KSCN溶液,溶液呈血红色。本小题答案为:FeCl3;2Fe3++Fe═3Fe2+;取少量B溶液于试管中,滴加少量KSCN溶液,呈血红色。
(3)若X是氢氧化钠溶液,A、B、C均为含铝元素的化合物,根据A![]() B
B![]() C的转化关系,span>A、B、C分别为铝盐、Al(OH)3、NaAlO2,则反应②的离子方程式为Al(OH)3+OH- =AlO2-+2H2O。本小题答案为:Al(OH)3+OH- =AlO2-+2H2O。
C的转化关系,span>A、B、C分别为铝盐、Al(OH)3、NaAlO2,则反应②的离子方程式为Al(OH)3+OH- =AlO2-+2H2O。本小题答案为:Al(OH)3+OH- =AlO2-+2H2O。


科目:高中化学 来源: 题型:
【题目】设NA表示阿伏伽德罗常数的值,下列判断正确的是
A. 高温下,5.6 g Fe与足量水蒸气反应,转移的电子数为0.3NA
B. 标准状况下,22.4 L NO和11.2 L O2充分反应,产物的分子数为NA
C. 60g乙酸与足量乙醇发生酯化反应,充分反应后断裂的C-O键数目为NA
D. 向含有0.2 mol NH4Al(SO4)2的溶液中滴加NaOH 溶液至沉淀恰好完全溶解,所消耗OH-的数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学原理具有极为广泛的应用,请回答下列问题:
(1)电镀是防止金属腐蚀的重要方法,铁制品表面上镀铜的装置示意图如图所示:
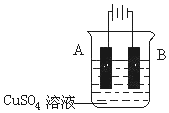
①A电极对应的金属是__________(写元素名称)。
②电镀前铁、铜两片金属质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为a g,则电镀时电路中通过的电子为_________mol。
(2)工业上常用电解熔融氯化镁获得金属镁,若电解槽中有水分,则生成的MgOHCl与阴极产生的Mg反应,使阴极表面产生MgO钝化膜,降低电解效率,写出生成MgO 的化学方程式_________________。
(3)“镁-次氯酸盐”燃料电池的装置如图所示:
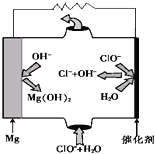
①该电池的正极反应式为__________________。
②若用该电池为电源,用惰性电极电解CuSO4溶液,电解一段时间后,向电解液中加入0.1mol Cu2(OH)2CO3,恰好使溶液恢复到电解前的浓度和pH。电解过程产生的气体体积(在标准状况下)为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 稀H2SO4 滴在铁片上:2Fe+6H+![]() 2Fe3++3H2↑
2Fe3++3H2↑
B. 稀盐酸滴在碳酸钙上:CO32―+2H+![]() CO2↑+H2O
CO2↑+H2O
C. 硫酸与氢氧化钡溶液混合:Ba2++SO42-![]() BaSO4↓
BaSO4↓
D. 氧化铜与盐酸反应:CuO +2H+![]() Cu2++H2O
Cu2++H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实中能说明亚硝酸是弱电解质的是( )
A. 用![]() 溶液做导电试验,灯光较暗
溶液做导电试验,灯光较暗
B. ![]() 是共价化合物
是共价化合物
C. 亚硝酸不与氯化钠反应
D. 常温下0.1mol/L亚硝酸溶液的氢离子约为0.01mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】框图中甲、乙为单质,其余均为化合物,B为常见液态化合物,A为淡黄色固体,F、G所含元素相同且均为氯化物,G遇KSCN溶液显红色。
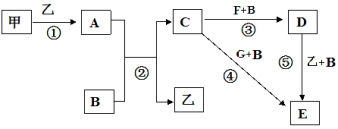
请问答下列问题:
(1)反应①-⑤中,既属于氧化还原反应又属于化合反应的是______________(填序号)。
(2)反应⑤的化学方程式为____________________________。
(3)甲与B反应的离子方程式 ______________________________。
(4)在实验室将C溶液滴入F溶液中,观察到的现象是_____________。
(5)在F溶液中加入等物质的量的A,发生反应的总的离子方程式为:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、W、Q、R是7种短周期元素,其原子半径及主要化合价如下:
元素代号 | X | Y | Z | M | W | Q | R |
原子半径/nm | 0.186 | 0.143 | 0.104 | 0.099 | 0.070 | 0.066 | 0.032 |
主要化合价 | +1 | +3 | +6,﹣2 | +7,﹣1 | +5,﹣3 | ﹣2 | +1 |
完成下列填空:
(1)上述元素中,金属性最强的在周期表中的位置是________________________________;X、Y、Q各自形成的简单离子中,离子半径由大到小的顺序是_______(填离子符号)。
W和R按原子个数比1﹕4构成的阳离子所含的化学键是____________________。
(2)表中所列4种第三周期元素的最高价氧化物的水化物碱性最弱的是_______(填化学
式),其电离方程式为_____________________________________。
(3)M与Z相比,非金属性较强的是_____________(填元素名称),请从原子结构的角度说明理由_________________________________________________________________。
(4)在稀硫酸中,KMnO4和H2O2能发生氧化还原反应,反应方程式如下:
![]() KMnO4+
KMnO4+![]() H2O2+
H2O2+![]() H2SO4 →
H2SO4 → ![]() K2SO4+
K2SO4+![]() MnSO4+
MnSO4+![]() O2↑+
O2↑+![]() H2O
H2O
请配平,当有0.5 mol H2O2参加此反应,电子转移的个数为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向10 mL 0.40 mol·L-1 H2O2溶液中加入适量FeCl3溶液,不同时刻测得生成O2的体积(已折算为标准状况)如下表所示。
t / min | 0 | 2 | 4 | 6 |
V(O2) / mL | 0 | 9.9 | 17.2 | 22.4 |
资料显示,反应分两步进行:
①2Fe3++ H2O2 ![]() 2Fe2++O2↑+2H+
2Fe2++O2↑+2H+
② H2O2 + 2Fe2++2H+ ![]() 2H2O+2Fe3+
2H2O+2Fe3+
反应过程中能量变化如右图所示。下列说法不正确的是

A. 0~6 min的平均反应速率:v(H2O2) = 3.33×10-2 mol·L-1·min-1
B. Fe3+的作用是加快过氧化氢的分解速率
C. 反应①是吸热反应、反应②是放热反应
D. 反应2H2O2(aq)![]() 2H2O(l) + O2(g)的△H =E1-E2 < 0
2H2O(l) + O2(g)的△H =E1-E2 < 0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com