
【题目】在常温下,Fe与水并不发生反应,但在高温下,Fe与水蒸气可发生反应。高温下Fe与水蒸气的反应实验应使用如图所示的装置,在硬质玻璃管中放入铁粉和石棉绒的混合物,通入水蒸气并加热。请回答实验的相关问题。
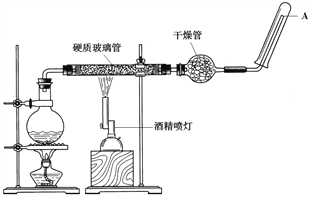
(1)该反应的反应方程式为_________。
(2)圆底烧瓶中装的是水,该装置的主要作用是______________;烧瓶底部放了几片碎瓷片,碎瓷片的作用是________________________。
(3)干燥管中盛装的物质是____________,作用是________________________。
(4)如果要在A处玻璃管口点燃该气体,则必须对该气体进行____________,方法是____________。
【答案】 3Fe+4H2O![]() Fe3O4+4H2 为硬质玻璃管内Fe与水蒸气的反应实验提供持续不断的水蒸气 防止暴沸 碱石灰 除去反应产生的H2中的水蒸气 验纯 用试管收集一试管气体,靠近酒精灯火焰,如果发出的声音是“啪”的爆鸣声,则证明氢气不纯,如果是“噗”的声音,则证明是纯净的氢气
Fe3O4+4H2 为硬质玻璃管内Fe与水蒸气的反应实验提供持续不断的水蒸气 防止暴沸 碱石灰 除去反应产生的H2中的水蒸气 验纯 用试管收集一试管气体,靠近酒精灯火焰,如果发出的声音是“啪”的爆鸣声,则证明氢气不纯,如果是“噗”的声音,则证明是纯净的氢气
【解析】试题分析:在高温下,Fe与水蒸气可发生反应,生成四氧化三铁和氢气。
(1)该反应的反应方程式为3Fe+4H2O![]() Fe3O4+4H2。
Fe3O4+4H2。
(2)圆底烧瓶中装的是水,该装置的主要作用是为硬质玻璃管内Fe与水蒸气的反应实验提供持续不断的水蒸气;烧瓶底部放了几片碎瓷片,碎瓷片的作用是防止暴沸。
(3)干燥管中盛装的物质是碱石灰,作用是除去反应产生的H2中的水蒸气。
(4)如果要在A处玻璃管口点燃该气体,则必须对该气体进行验纯,方法是:用试管收集一试管气体,靠近酒精灯火焰,如果发出的声音是“啪”的爆鸣声,则证明氢气不纯,如果是“噗”的声音,则证明是纯净的氢气。


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:
【题目】下列实验方案设计中,可行的是( )
A. 加稀盐酸后过滤,除去混在铜粉中的少量镁粉和铝粉
B. 用萃取的方法分离汽油和煤油
C. 用溶解、过滤的方法分离KNO3和 NaCl固体的混合物
D. 将氧气和氢气的混合气体通过灼热的氧化铜,以除去其中的氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.(1)实验室常用石灰石与盐酸反应制取CO2,请写出该反应的离子方程式__________。
(2)实验室常用锌粒与稀硫酸制取氢气,请写出该反应的离子方程式__________。
Ⅱ.(1)实验室常将饱和三氯化铁溶液滴入沸水中继续加热至红褐色制备氢氧化铁胶体,请写出制备氢氧化铁胶体的化学方程式___________。
(2)将Fe(OH)3 胶体装入U形管内,用石墨做电极,接通直流电,通电一段时间后发现阴极附近的颜色逐渐加深,这表明Fe(OH)3胶体微粒带 _________ (填“正”或“负”)电荷。
(3)取少量Fe(OH)3 胶体于试管中,逐滴加入硫酸至过量,可看到的现象是____________。
(4)3.4gOH-中有_________mol OH-,其含有的电子数是_______个(阿伏加德罗常数用NA表示)。在同温同压下CH4和N2组成的混合气体对H2的相对密度为10,则混合气体中CH4与N2的体积比为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知四种元素A、B、C、D,其原子序数依次增大,最外层电子数依次为4、1、2、7,其中A元素原子次外层电子数为2,B、C 两元素的原子次外层电子数为8,B元素原子最外层电子数比第1层电子数少1,也比C元素原子第M层电子数少1,D元素的单质为液态非金属单质。若此四种元素均位于元素周期表前四个周期,请按要求填写下列各题:
(1)A原子的原子结构示意图为_____,D元素在元素周期表中的位置为______。
(2)B元素的最高价氧化物对应的水化物用电子式表示为______________,C、D两元素形成的化合物化学键类型为__________。
(3)请写出D元素的单质与SO2同时通入水中反应的化学方程式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列有关问题。
(1)某工业废水中仅含下表离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为0.1mol/L。
阳离子 | K+ | Cu2+ | Fe3+ | Al3+ | Fe2+ |
阴离子 | Cl- | CO32— | NO3— | SO42— | SiO32— |
某同学欲探究废水的组成,进行了如下实验:
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察)。
Ⅱ.取少量溶液,加入KSCN溶液无明显变化。
Ⅲ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:原溶液中所含阳离子是___________________,阴离子是_____________________。
(2)光伏发电是当今世界利用太阳能最主要方式之一。图1为光伏并网发电装置,图2为电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。
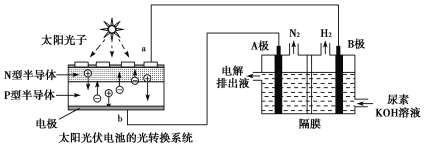
图1 图2
①图1中N型半导体为____________(填“正极”或“负极”)
②该系统工作时,A极的电极反应式为___________________________________________。
③若A极产生7.00gN2,则此时B极产生_____________LH2(标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.76 g铜镁合金完全溶解于50 mL、密度为1. 40 g cm-3、质量分数为63%的浓硝酸中,得到NO2气体1 792 mL(标准状况),向反应后的溶液中加入适量的1.0 mol L-1的NaOH 溶液,恰使溶液中的金属离子全部沉淀。下列说法不正确的是
A. 该浓硝酸中的HNO3的物质的量浓度是14.0 mol L-1
B. 加入NaOH溶液的体积是50 mL
C. 浓硝酸在与合金的反应中起了酸性和氧化性的双重作用,且起氧化性的硝酸的物质的量为0.08 mol
D. 得到的金属氢氧化物的沉淀为3.12 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四甲基氢氧化铵[(CH3)4NOH]常用作电子工业清洗剂,以四甲基氯化铵[(CH3)4NCl]为原料,采用电渗析法合成(CH3)4NOH,其工作原理如下图所示(a、b为石墨电板,c、d、e为离子交换膜),下列说法正确的是( )
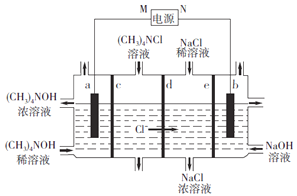
A. M为正极 B. c、e均为阳离子交换膜
C. b极电极反应式:2H2O-4e-=O2↑+4H+ D. 制备1mol(CH3)4NOH,a、b两极共产生0.5mol气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某Fe 2(SO4) 3样品含有少量FeSO4杂质,为了测定该样品中铁元素的含量,设计如下实验:
Ⅰ.称取样品m g,加入稀H2SO4,后加水配制成250.00 mL溶液;
Ⅱ.取25.00 mL溶液,先加入H2O2,然后再加过量的氨水,过滤;
Ⅲ.将沉淀用蒸馏水洗涤数次后,烘干;
Ⅳ.灼烧至质量不再减少为止,得到红棕色固体,冷却后称量,质量为n g。
请根据上面操作流程,回答以下问题:
①步骤Ⅰ中称量使用的仪器是________________,配制用到的仪器有烧杯、玻璃棒、胶头滴管,还要补充的玻璃仪器是____________________。
②步骤Ⅱ中过滤用的仪器有滤纸、铁架台、铁圈和烧杯,还要补充的玻璃仪器是________;加入H2O2的主要目的是_______________________________。
③若要检验溶液中的Fe3+,则应该加入________________试剂。
④步骤Ⅲ中检验该沉淀已经洗涤干净的操作是________________。
⑤计算该样品中铁元素的质量分数的表达式是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
![]()
① 用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
② 固定好滴定管并使滴定管尖嘴充满液体;
③ 调节液面至“0”或“0”刻度线稍下,并记下读数;
④ 移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤ 用标准液滴定至终点,记下滴定管液面读数。
请回答:
(1)以上步骤有误的是(填编号)____,若测定结果偏高,其原因可能是______.
A.配制标准溶液的固体NaOH中混有KOH杂质
B.滴定终点读数时,仰视滴定管的刻度,其他操作正确
C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗
D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
(2)判断滴定终点的现象是____________________________。
(3)如下图是某次滴定时的滴定管中的液面,其读数为________mL。
(4)根据下列数据:请计算待测盐酸溶液的浓度______mol/L。
滴定次数 | 待测体积(mL) | 标准烧碱体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.40 | 20.40 |
第二次 | 20.00 | 2.00 | 24.10 |
第三次 | 20.00 | 4.00 | 24.00 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com