
【题目】Ⅰ.(1)实验室常用石灰石与盐酸反应制取CO2,请写出该反应的离子方程式__________。
(2)实验室常用锌粒与稀硫酸制取氢气,请写出该反应的离子方程式__________。
Ⅱ.(1)实验室常将饱和三氯化铁溶液滴入沸水中继续加热至红褐色制备氢氧化铁胶体,请写出制备氢氧化铁胶体的化学方程式___________。
(2)将Fe(OH)3 胶体装入U形管内,用石墨做电极,接通直流电,通电一段时间后发现阴极附近的颜色逐渐加深,这表明Fe(OH)3胶体微粒带 _________ (填“正”或“负”)电荷。
(3)取少量Fe(OH)3 胶体于试管中,逐滴加入硫酸至过量,可看到的现象是____________。
(4)3.4gOH-中有_________mol OH-,其含有的电子数是_______个(阿伏加德罗常数用NA表示)。在同温同压下CH4和N2组成的混合气体对H2的相对密度为10,则混合气体中CH4与N2的体积比为_____。
【答案】CaCO3+2H+=Ca2++CO2↑+H2O H++Zn=H2↑+Zn2+ FeCl3+3H2O![]() Fe(OH)3(胶体)+3HCl 正 先产生红褐色沉淀,接着沉淀又消失生成棕黄色溶液 0.2 2NA 2:1
Fe(OH)3(胶体)+3HCl 正 先产生红褐色沉淀,接着沉淀又消失生成棕黄色溶液 0.2 2NA 2:1
【解析】
Ⅰ.(1)碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,据此书写;
(2)锌与稀硫酸反应生成硫酸锌和氢气,据此书写;
Ⅱ.(1)氯化铁与沸水反应生成氢氧化铁胶体,据此书写;
(2)根据氢氧化铁胶体能产生电泳现象分析判断;
(3)根据胶体可以发生聚沉以及氢氧化铁能与稀硫酸反应分析判断;
(4)根据m=nM、阿伏加德罗定律以及物质的组成分析计算。
Ⅰ.(1)实验室常用石灰石与盐酸反应制取CO2,该反应的离子方程式为CaCO3+2H+=Ca2++CO2↑+H2O。
(2)实验室常用锌粒与稀硫酸制取氢气,该反应的离子方程式为2H++Zn=H2↑+Zn2+。
Ⅱ.(1)实验室常将饱和三氯化铁溶液滴入沸水中继续加热至红褐色制备氢氧化铁胶体,制备氢氧化铁胶体的化学方程式为FeCl3+3H2O![]() Fe(OH)3(胶体)+3HCl。
Fe(OH)3(胶体)+3HCl。
(2)将Fe(OH)3胶体装入U形管内,用石墨做电极,接通直流电,通电一段时间后发现阴极附近的颜色逐渐加深,这说明氢氧化铁的胶粒向阴极移动,则Fe(OH)3胶体微粒带正电荷。
(3)取少量Fe(OH)3胶体于试管中,逐滴加入硫酸至过量,开始胶体发生聚沉产生氢氧化铁沉淀,然后氢氧化铁和稀硫酸发生中和反应生成硫酸铁和水,所以可看到的现象是先产生红褐色沉淀,接着沉淀又消失生成棕黄色溶液。
(4)3.4gOH-中含有OH-的物质的量是3.4g÷17g/mol=0.2mol,1个氢氧根离子含有10个电子,则其中含有的电子数是2NA个。在同温同压下CH4和N2组成的混合气体对H2的相对密度为10,则根据阿伏加德罗定律可知混合气体的平均相对分子质量是10×2=20,所以依据十字交叉法可知混合气体中CH4与N2的体积比为(28-20)/(20-16)=2:1。


科目:高中化学 来源: 题型:
【题目】下列事实中能说明亚硝酸是弱电解质的是( )
A. 用![]() 溶液做导电试验,灯光较暗
溶液做导电试验,灯光较暗
B. ![]() 是共价化合物
是共价化合物
C. 亚硝酸不与氯化钠反应
D. 常温下0.1mol/L亚硝酸溶液的氢离子约为0.01mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将NO2装入带有活塞的密闭容器中,当反应2NO2(g)![]() N2O4(g)达到平衡后,改变下列一个条件,下列叙述正确的是
N2O4(g)达到平衡后,改变下列一个条件,下列叙述正确的是
A. 升高温度,气体颜色加深,则此反应为吸热反应
B. 慢慢压缩气体体积,平衡向正反应方向移动,混合气体的颜色变浅
C. 慢慢压缩气体体积,若体积减小一半,压强增大,但小于原来的两倍
D. 恒温恒容时,充入稀有气体,压强增大,平衡向正反应方向移动,混合气体的颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定质量的AlCl3和MgCl2混合溶液中逐渐滴入一定溶质质量分数的NaOH溶液,生成沉淀的物质的量与加入NaOH的物质的量的关系如图所示,则:
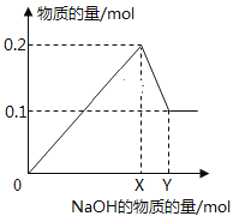
(1)O-X段反应的离子方程式为:________________________,
(2)X-Y段反应的离子方程式为_________________________
(3)生成Mg(OH)2的质量为___________________g;
(4)X=________________;Y=______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图装置研究电化学原理,下列分析中错误的是
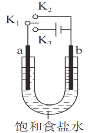
选项 | 连接 | 电极材料 | 分析 | |
a | b | |||
A | K1K2 | 石墨 | 铁 | 模拟铁的吸氧腐蚀 |
B | K1K2 | 锌 | 铁 | 模拟钢铁防护中牺牲阳极的阴极保护法 |
C | K1K3 | 石墨 | 铁 | 模拟电解饱和食盐水 |
D | K1K3 | 铁 | 石墨 | 模拟钢铁防护中外加电流的阴极保护法 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向10 mL 0.40 mol·L-1 H2O2溶液中加入适量FeCl3溶液,不同时刻测得生成O2的体积(已折算为标准状况)如下表所示。
t / min | 0 | 2 | 4 | 6 |
V(O2) / mL | 0 | 9.9 | 17.2 | 22.4 |
资料显示,反应分两步进行:
①2Fe3++ H2O2 ![]() 2Fe2++O2↑+2H+
2Fe2++O2↑+2H+
② H2O2 + 2Fe2++2H+ ![]() 2H2O+2Fe3+
2H2O+2Fe3+
反应过程中能量变化如右图所示。下列说法不正确的是

A. 0~6 min的平均反应速率:v(H2O2) = 3.33×10-2 mol·L-1·min-1
B. Fe3+的作用是加快过氧化氢的分解速率
C. 反应①是吸热反应、反应②是放热反应
D. 反应2H2O2(aq)![]() 2H2O(l) + O2(g)的△H =E1-E2 < 0
2H2O(l) + O2(g)的△H =E1-E2 < 0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.锌﹣锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)![]() Zn(OH)2(s)+Mn2O3(s) 下列说法错误的是( )
Zn(OH)2(s)+Mn2O3(s) 下列说法错误的是( )
A. 电池工作时,锌失去电子
B. 电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e﹣=Mn2O3(s)+2OH﹣(aq)
C. 电池工作时,电子由正极通过外电路流向负极
D. 外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下,Fe与水并不发生反应,但在高温下,Fe与水蒸气可发生反应。高温下Fe与水蒸气的反应实验应使用如图所示的装置,在硬质玻璃管中放入铁粉和石棉绒的混合物,通入水蒸气并加热。请回答实验的相关问题。
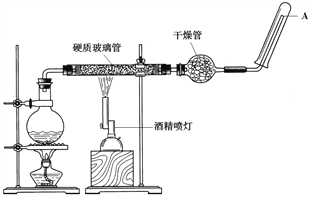
(1)该反应的反应方程式为_________。
(2)圆底烧瓶中装的是水,该装置的主要作用是______________;烧瓶底部放了几片碎瓷片,碎瓷片的作用是________________________。
(3)干燥管中盛装的物质是____________,作用是________________________。
(4)如果要在A处玻璃管口点燃该气体,则必须对该气体进行____________,方法是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com