
����Ŀ��ijѧ����0.2000mol��L-1�ı�NaOH��Һ�ζ�δ֪Ũ�ȵ����ᣬ��������£�
![]()
�� ������ˮϴ�Ӽ�ʽ�ζ��ܣ�������ע��NaOH��Һ����0���̶������ϣ�
�� �̶��õζ��ܲ�ʹ�ζ��ܼ������Һ�壻
�� ����Һ������0����0���̶������£������¶�����
�� ��ȡ20.00mL����Һע��ྻ����ƿ�У�������3�η�̪��Һ��
�� �ñ�Һ�ζ����յ㣬���µζ���Һ�������
��ش�
��1�����ϲ���������ǣ����ţ�____�����ⶨ���ƫ�ߣ���ԭ�������______��
A�����Ʊ���Һ�Ĺ���NaOH�л���KOH����
B���ζ��յ����ʱ�����ӵζ��ܵĿ̶ȣ�����������ȷ
C��ʢװδ֪Һ����ƿ������ˮϴ��������δ֪Һ��ϴ
D���ζ����յ����ʱ�����ֵζ��ܼ��촦����һ����Һ
��2���жϵζ��յ��������____________________________��
��3������ͼ��ij�εζ�ʱ�ĵζ����е�Һ�棬�����Ϊ________mL��
��4�������������ݣ���������������Һ��Ũ��______mol/L��
�ζ����� | ���������mL�� | ���ռ������mL�� | |
�ζ�ǰ���� | �ζ������ | ||
��һ�� | 20.00 | 0.40 | 20.40 |
�ڶ��� | 20.00 | 2.00 | 24.10 |
������ | 20.00 | 4.00 | 24.00 |
���𰸡� �� AD �������һ������������Һ����Һ����ɫ��Ϊdz��ɫ���ұ���30�벻��ɫ 22.60 0.2000
����������1����ʽ�ζ���Ӧ������������ˮ��ϴ��Ȼ���ñ�NaOH��Һ��ϴ�������Ӱ���Һ��Ũ�ȣ��ʵ������������Ʊ���Һ�Ĺ���NaOH�л���KOH����������Һ�����������ӵ�Ũ��ƫС,���ĵ�V(��)������![]() ���ⶨ���ƫ��,����Aѡ������ȷ�����ζ��յ����ʱ,���ӵζ��ܵĿ̶�,���ĵ�V(��)ƫС����
���ⶨ���ƫ��,����Aѡ������ȷ�����ζ��յ����ʱ,���ӵζ��ܵĿ̶�,���ĵ�V(��)ƫС����![]() �������ⶨ���ƫ��������B������ʢװδ֪Һ����ƿ������ˮϴ��������δ֪Һ��ϴ�����ĵ�V(��)������
�������ⶨ���ƫ��������B������ʢװδ֪Һ����ƿ������ˮϴ��������δ֪Һ��ϴ�����ĵ�V(��)������![]() �������ⶨ�������,��C�������ζ����յ����ʱ�����ֵζ��ܼ��촦����һ����Һ�����ĵ�V(��)ƫ����
�������ⶨ�������,��C�������ζ����յ����ʱ�����ֵζ��ܼ��촦����һ����Һ�����ĵ�V(��)ƫ���� ![]() �������ⶨ���ƫ��������Dѡ������ȷ������ȷѡ��.AD��
�������ⶨ���ƫ��������Dѡ������ȷ������ȷѡ��.AD��
��2���ζ��յ�������������������һ��NaOH��Һʱ����ƿ����Һ����ɫ��Ϊdz��ɫ���ұ���30�벻��ʧ����ȷ�𰸣��������һ������������Һ����Һ����ɫ��Ϊdz��ɫ������30�벻��ʧ��
��3���ζ����е�Һ�����Ϊ![]() ����ȷ����22.60��
����ȷ����22.60��
��4�����εζ����ĵ����Ϊ20.00mL ��22.1 mL��20.00mL���ڶ������ݲ����������������������Ƶ����![]() ������
������![]() =0.2��20��10-3/20��10-3= 0.2000 mol/L����ȷ�𰸣�0.2000��
=0.2��20��10-3/20��10-3= 0.2000 mol/L����ȷ�𰸣�0.2000��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڳ����£�Fe��ˮ����������Ӧ�����ڸ����£�Fe��ˮ�����ɷ�����Ӧ��������Fe��ˮ�����ķ�Ӧʵ��Ӧʹ����ͼ��ʾ��װ�ã���Ӳ�ʲ������з������ۺ�ʯ���Ļ���ͨ��ˮ��������������ش�ʵ������������
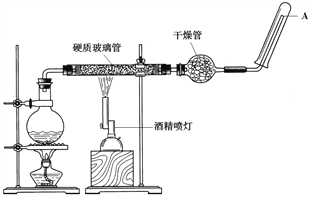
��1���÷�Ӧ�ķ�Ӧ����ʽΪ_________��
��2��Բ����ƿ��װ����ˮ����װ�õ���Ҫ������______________����ƿ�ײ����˼�Ƭ���Ƭ�����Ƭ��������________________________��
��3���������ʢװ��������____________��������________________________��
��4�����Ҫ��A�������ܿڵ�ȼ�����壬�����Ը��������____________��������____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������У���������ͼ���ʼ�ת����ϵ�����ʼ�ķ�Ӧ��Ϊһ��ת������ѡ����


A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ����������������ϡH2SO4��������CuO�Ƶ���ͭ����������������ַ�����
��Fe ![]() H2
H2 ![]() Cu �� �� CuO
Cu �� �� CuO ![]() CuSO4
CuSO4 ![]() Cu ��
Cu ��
��ʵ������У�����һ���ʵ�鷽����ʵ�����������в�������������Ƶõ���ͭ�������Ƚϣ���ȷ����
A. ��� B. �ٶ� C. �ڶ� D. ���ж�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������̿���������Ӫ��ǿ��������ýȾ����������ԭ�������̿�(MnO2)�����̿�(MnCO3)�г�������������������þ�����ʣ���������������ͼ��ʾ��
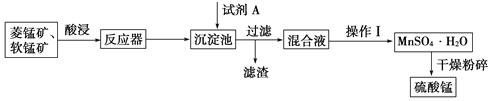
��֪����1�������̾��������þ������ܽ��������ͼ��ʾ��
��2����������ȫ������pH��Fe3��Ϊ3.5��Fe2��Ϊ9.5��Mn2��Ϊ10.8��Mg2��Ϊ11.6�������ж���ȷ����
A. �Լ�AӦ��ѡ��H2O2��Ŀ���ǽ�Fe2������ΪFe3��
B. �Լ�AӦ��ѡ��ˮ��Ŀ���ǵ�����Һ��pH
C. �������������Ũ������ȴ�ᾧ�����ȹ��ˡ�ϴ�ӵȲ��裬ϴ��ʱ����ϡ������ϴ��Һ
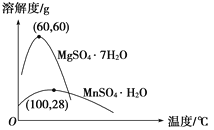
D. ͨ��������õ�MnSO4��H2O�Ĺ����У����������ᾧ���������ᾧʱ���¶�Ӧ�ø���60 ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NiSO4��6H2O��һ����ɫ������ˮ�ľ��壬���ɵ�Ʒ���(�����⣬������ͭ��п������Ԫ��)Ϊԭ�ϻ�á������������£�
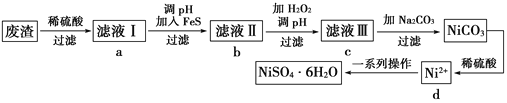
��1������Һ���м���FeS��Ϊ��������������������������ȥCu2����Zn2�������ʣ����ȥCu2�������ӷ���ʽΪ___________________________________��
��2������Һ��IJ�������ش�
������Һ���м���H2O2�����ӷ���ʽΪ________________________________��
�ڵ���Һ��pH��Ŀ���dz�ȥFe3������ԭ����Fe3����3H2O![]() Fe(OH)3��3H������֪25 ��ʱKsp[Fe(OH)3]��2.8��10��39������¶���������Ӧ��ƽ�ⳣ��K��________________��
Fe(OH)3��3H������֪25 ��ʱKsp[Fe(OH)3]��2.8��10��39������¶���������Ӧ��ƽ�ⳣ��K��________________��
�ۼ���Fe3���Ƿ�����IJ�����������__________________________________________��
��3����Һ�������ʵ���Ҫ�ɷ���NiSO4����Na2CO3���˺�õ�NiCO3���壬�ټ�����ϡ�����ܽ�������NiSO4��������������Ŀ����___________________��
��4���õ���NiSO4��Һ������Ũ������ȴ�ᾧ�����˵�һϵ�в����ɵõ�NiSO4��6H2O����ش�
���ڽ�������Ũ������ʱ�����ȵ�___________________________(����ʵ������)ʱ����ֹͣ���ȡ�
��Ϊ����߲��ʣ����˺�õ���ĸҺҪѭ��ʹ�ã���Ӧ�û����������е�________λ��(ѡ��a��b��c��d)��
������õ���Ʒ�Ĵ��Ȳ�������Ӧ�ý���________(���������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ����20ml 0.1mol��L��1NaOH��Һ����μ���0.2mol��L��1������Һ���ζ�������ͼ�� ʾ���й�����Ũ�ȵĹ�ϵ�У�����ȷ���ǣ� ��

A. ��A�㣺c(Na��)��c(OH��)��c(CH3COO��)��c(H��)
B. ��B�㣺c(Na��) ��c(CH3COO��) ��c(OH��)��c(H��)
C. ��C�㣺c(CH3COO��)��c(Na��)��c(H��) ��c(OH��)
D. ��C�㣺c(CH3COO��)��c(CH3COOH)��2 c(Na��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ��ʾ��װ���У���ƿ�г�����������a�����ι��е�Һ��b������ƿ�ڣ���������ƿ��Ȼ����ɼ�f���ձ��е�Һ��b����Ȫ״��������ռ���������ƿ����a��b��������ĿҪ�����
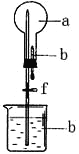
ѡ�� | a���������壩 | b��Һ�壩 |
A | Cl2 | ����NaOH��Һ |
B | SO2 | 4mol/LNaOH��Һ |
C | NO2 | ˮ |
D | NH3 | 1mol/L���� |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ե�ؾ��������ŵ��������ص㣬����õ��㷺Ӧ�ã�п���̼��Ե��������������ҺΪ���Һ������ܷ�ӦʽΪ��Zn��s��+2MnO2��s��+H2O��l��![]() Zn��OH��2��s��+Mn2O3��s�� ����˵��������ǣ� ��
Zn��OH��2��s��+Mn2O3��s�� ����˵��������ǣ� ��
A. ��ع���ʱ��пʧȥ����
B. ��������ĵ缫��ӦʽΪ��2MnO2��s��+H2O��1��+2e��=Mn2O3��s��+2OH����aq��
C. ��ع���ʱ������������ͨ�����·����
D. ���·��ÿͨ��0.2mol���ӣ�п�����������ϼ�С6.5g
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com