
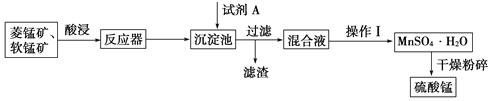
【题目】硫酸锰可用于饮料营养强氧化剂和媒染剂。其生产原材料软锰矿(MnO2)、菱锰矿(MnCO3)中常混有硫酸亚铁和硫酸镁等杂质,生产工艺流程如图所示:
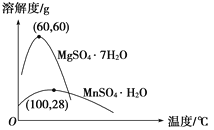
已知:(1)硫酸锰晶体和硫酸镁晶体的溶解度曲线如图所示。
(2)各离子完全沉淀的pH:Fe3+为3.5,Fe2+为9.5,Mn2+为10.8,Mg2+为11.6。下列判断正确的是
A. 试剂A应该选择H2O2,目的是将Fe2+氧化为Fe3+
B. 试剂A应该选择氨水,目的是调节溶液的pH
C. 操作Ⅰ包括蒸发浓缩、冷却结晶、趁热过滤、洗涤等步骤,洗涤时可用稀硫酸作洗涤液
D. 通过操作Ⅰ得到MnSO4·H2O的过程中,包括蒸发结晶,在蒸发结晶时,温度应该高于60 ℃
【答案】D
【解析】
软锰矿中的二氧化锰具有强氧化性,可将Fe2+氧化为Fe3+。试剂A可起到调节pH的作用,使铁离子水解生成沉淀而除去,将滤液蒸发浓缩、结晶得到硫酸锰,分离硫酸锰和硫酸镁,应注意二者溶解度的差异,以此解答该题。
软锰矿中二氧化锰具有强氧化性,可将Fe2+氧化为Fe3+。试剂A可起到调节pH的作用,使铁离子水解生成沉淀而除去,将滤液蒸发、结晶得到硫酸锰。A.试剂A起到调节pH的作用,使铁离子水解生成沉淀而除去。因二氧化锰具有强氧化性,无需加入过氧化氢,故A错误;B.A不能是氨水,否则金属离子都生成沉淀,故B错误;C.操作I用于分离硫酸锰和硫酸镁,由于硫酸锰晶体的溶解度随温度变化不大、而硫酸镁晶体的溶解度随温度变化较大,故操作I应包括蒸发结晶、趁热过滤、洗涤、干燥等步骤,为减少硫酸锰晶体的溶解损失,可以用稀硫酸洗涤,C错误;D.温度高于60°C,硫酸锰晶体的溶解度减小,利于蒸发结晶,而在60°C ~100°C硫酸镁的溶解度较大,故D正确,选D。


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
【题目】回答下列有关问题。
(1)某工业废水中仅含下表离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为0.1mol/L。
阳离子 | K+ | Cu2+ | Fe3+ | Al3+ | Fe2+ |
阴离子 | Cl- | CO32— | NO3— | SO42— | SiO32— |
某同学欲探究废水的组成,进行了如下实验:
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察)。
Ⅱ.取少量溶液,加入KSCN溶液无明显变化。
Ⅲ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:原溶液中所含阳离子是___________________,阴离子是_____________________。
(2)光伏发电是当今世界利用太阳能最主要方式之一。图1为光伏并网发电装置,图2为电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。
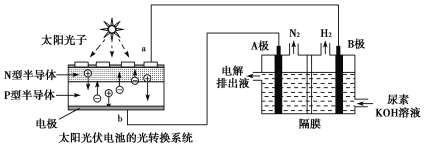
图1 图2
①图1中N型半导体为____________(填“正极”或“负极”)
②该系统工作时,A极的电极反应式为___________________________________________。
③若A极产生7.00gN2,则此时B极产生_____________LH2(标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌与100mL 18.5molL-1的浓硫酸充分反应后,锌完全溶解,同时生成气体甲35.84L(标准状况)。将反应后的溶液稀释至1L,测得溶液中c(H+)=0.1 mol/L,下列叙述不正确的是( )
A. 反应中共消耗1.8molH2SO4
B. 气体甲中SO2与H2的体积比为7:1
C. 反应中共消耗1.6molZn
D. 反应中共转移3.2mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置不能达到实验目的的是
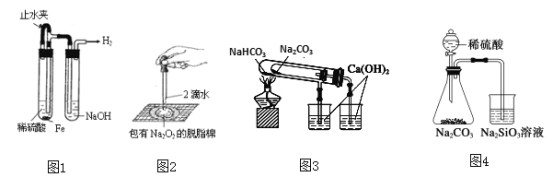
A. 图1:制备并观察氢氧化亚铁
B. 图2:证明过氧化钠与水反应放热
C. 图3:验证NaHCO3和Na2CO3的热稳定性
D. 图4:验证酸性强弱H2SO4>H2CO3>H2SiO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验室模拟以工业用菱铁矿(FeCO3)含碱式碳酸铜[Cu2(OH)2CO3]为原料制取纯净的FeCO3和氯化铜晶体(CuCl2·2H2O)的生产流程如下:
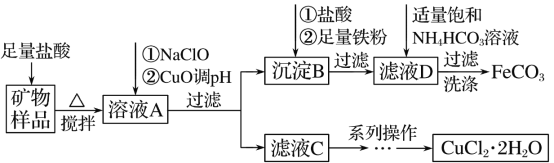
(1)盐酸溶解矿物样品时可能发生的离子方程式______。
(2)写出向溶液A中加入NaClO的离子方程式_________。
(3)向沉淀B中依次加入盐酸和铁粉时可能发生的离子方程式_________。
(4)处理滤液D时,除产生沉淀外,还产生无色气体,写出该反应的离子方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
![]()
① 用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
② 固定好滴定管并使滴定管尖嘴充满液体;
③ 调节液面至“0”或“0”刻度线稍下,并记下读数;
④ 移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤ 用标准液滴定至终点,记下滴定管液面读数。
请回答:
(1)以上步骤有误的是(填编号)____,若测定结果偏高,其原因可能是______.
A.配制标准溶液的固体NaOH中混有KOH杂质
B.滴定终点读数时,仰视滴定管的刻度,其他操作正确
C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗
D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
(2)判断滴定终点的现象是____________________________。
(3)如下图是某次滴定时的滴定管中的液面,其读数为________mL。
(4)根据下列数据:请计算待测盐酸溶液的浓度______mol/L。
滴定次数 | 待测体积(mL) | 标准烧碱体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.40 | 20.40 |
第二次 | 20.00 | 2.00 | 24.10 |
第三次 | 20.00 | 4.00 | 24.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酸性溶液中只有Na+、CH3COO﹣、H+、OH﹣四种离子.则下列描述正确的是
A. 该溶液可由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合而成
B. 该溶液可由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成
C. 加入适量NaOH,溶液中离子浓度为c(CH3COO﹣)>c(Na+ )>c(OH﹣)>c(H+)
D. 加入适量氨水,c(CH3COO﹣)一定大于c(Na+)、c(NH4+)之和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色工业废水中可能含有Na+、Mg2+、Al3+、Cl-、SO42-中的几种离子。
a.取少许该废水于试管中,加入足量的Ba(NO3)2溶液和稀硝酸,产生白色沉淀,充分反应后过滤,向滤液中加入AgNO3溶液无沉淀产生。
b.另取10mL该废水于试管中,滴加NaOH溶液先产生白色沉淀,后部分沉淀溶解生成沉淀的物质的量随加入NaOH的物质的量关系如下图所示。
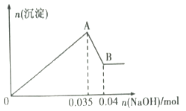
根据上述实验和图中数据:
(1)该废水中一定不含有的离子有________(填离子符号);
(2)A点沉淀的化学式___________________;
(3)写出A→B过程中发生反应的离子方程式:____________________________;
(4)该废水中,c(Al3+)=________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质:①C60、C70、金刚石、石墨; ②苯甲醇、对甲基苯酚、邻甲基苯酚、间甲基苯酚;③![]() C、
C、![]() C、
C、![]() C;④HOCH2CHO、HOCH2CH2CHO、HOCH2CH2CH2CHO;⑤新戊烷、2,2-二甲基丙烷; ⑥甲醇、乙二醇、丙三醇。
C;④HOCH2CHO、HOCH2CH2CHO、HOCH2CH2CH2CHO;⑤新戊烷、2,2-二甲基丙烷; ⑥甲醇、乙二醇、丙三醇。
从左至右按同类有机物、同位素、同系物、同分异构体、同素异形体、同种物质的顺序排列正确的是( )
A. ①⑥②③⑤④ B. ⑥③⑤④①②
C. ④②⑥①⑤③ D. ⑥③④②①⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com