
����Ŀ��ijʵ����ģ���Թ�ҵ��������(FeCO3)����ʽ̼��ͭ[Cu2(OH)2CO3]Ϊԭ����ȡ������FeCO3���Ȼ�ͭ����(CuCl2��2H2O)����������������
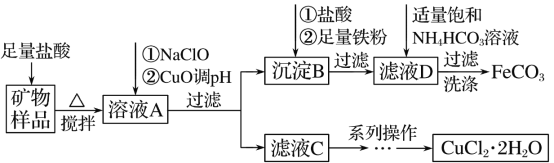
��1�������ܽ������Ʒʱ���ܷ��������ӷ���ʽ______��
��2��д������ҺA�м���NaClO�����ӷ���ʽ_________��
��3�������B�����μ������������ʱ���ܷ��������ӷ���ʽ_________��
��4��������ҺDʱ������������������������ɫ������д���÷�Ӧ�����ӷ���ʽ_________��
���𰸡�FeCO3+2H+��Fe2++CO2��+H2O��Cu2(OH)2CO3+4H+��2Cu2++CO2��+3H2O2Fe2++ClO-+2H+��2Fe3++Cl-+H2OFe(OH)3+3H+��Fe3++3H2O��2Fe3++Fe��3Fe2+��Fe+2H+��Fe2++H2��Fe2++2HCO3-��FeCO3��+CO2��+H2O
��������
��1�����������Ҫ�ɷ���FeCO3��������ʽ̼��ͭ[Cu2(OH)2CO3]����������ܽ������Ʒʱ���ܷ��������ӷ�Ӧ����ʽΪFeCO3+2H+��Fe2++CO2��+H2O��Cu2(OH)2CO3+4H+��2Cu2++CO2��+3H2O��
��2���������ƾ���ǿ�����ԣ��ܰ���Һ�е�������������Ϊ�����ӣ���Ӧ�����ӷ���ʽΪ2Fe2++ClO-+2H+��2Fe3++Cl-+H2O��
��3��ͨ������pHʹ������ת��Ϊ���������������������B�����μ������������ʱ���ܷ��������ӷ���ʽΪFe(OH)3+3H+��Fe3++3H2O��2Fe3++Fe��3Fe2+��Fe+2H+��Fe2++H2����
��4����ҺD�к����������ӣ���̼���������ˮ����ٽ�����Ӧ�����ӷ���ʽΪFe2++2HCO3-��FeCO3��+CO2��+H2O��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��SO2��һ����Ҫ��������,���������������������ᡢ�������Ρ����������,Ҳ������Ѭ������������������������ԭ���ȡ�
(1)SO2���ʶ��,����SO2����ͨ����������,�ܿ���������Ϊ:__________,�÷�Ӧ��SO2���ֳ�______��;����SO2����ͨ�����Ը��������Һ��,���ӷ�Ӧ����ʽΪ_________,�÷�Ӧ��SO2���ֳ�__________�ԡ�
(2)SO2�ж�,�����γ�����,�Ǵ�����Ҫ��Ⱦ��֮һ��ʯ��-ʯ�෨�ͼ�dz��õ���������ʯ��-ʯ�෨������ԭ��:��SO2+Ca(OH)2=CaSO3��+H2O��2CaSO3+O2+4H2O=2CaSO4��2H2O�������ԭ��:����SO2��β��ͨ���������ռ���Һ��,��д����Ӧ�Ļ�ѧ��Ӧ����ʽ__________;
��֪:
�Լ� | Ca(OH)2 | NaOH |
�۸�(Ԫ/kg) | 0.36 | 2.9 |
��ʯ��-ʯ�෨���,����ŵ������տ졢Ч�ʸ�,ȱ����__________;
(3)��ʯ��-ʯ�෨�ͼ�Ļ�����,�����˫�,��ʵ������ѭ�����á�

����������,ʵ��ѭ�����õ�������__________,���û�ѧ����ʽ��ʾ��Na2SO3��Һ�м���CaO��ķ�Ӧԭ��__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������G[ ]��һ��ҽҩ�м��壬����һ�ֺϳ�·�����£�
]��һ��ҽҩ�м��壬����һ�ֺϳ�·�����£�

��֪��
��ش�����������
��1��A��������_____________��
��2��B��C�ķ�Ӧ����Ϊ_____________��
A��B��D��E�ķ�Ӧ���ͷֱ���_____________��_____________��
��3��D��Ũ������ȵ������»�����һ�ֺ���Ԫ���Ļ�����û�����Ľṹ��ʽΪ_____________����4��H��һ�ָ߾�����D��H�Ļ�ѧ����ʽΪ_____________��
��5�����й��ڻ�����G��˵���������_____________��
A.G�ķ���ʽΪC12H14O5
B.1molG��NaOH��Һ�����������2molNaOH
C.һ��������G������ȥ��Ӧ���ɵ��л������˳���칹��
D.��һ��������G����HBr����ȡ����Ӧ
��6��M��D��ͬ���칹�壬��D������ͬ�Ĺ����š���M���ܵĽṹ��____�֡�
��7����֪���ǻ����������ᷢ��������Ӧ��д���ɱ��ӣ��ױ�Ϊԭ���Ʊ������ᱽ������![]() ���ĺϳ�·��(�����Լ���ѡ)�� __________________
���ĺϳ�·��(�����Լ���ѡ)�� __________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ�����ۺ�ͭ�ۻ�Ϸ�ĩ��Ϊȷ������ɣ����ṩ4mol/L��FeCl3��Һ��������Ʒ�ԣ���ij����ѧϰС��ͬѧ��ʵ�������£��ٶ���Ӧǰ����Һ������䣩�� ��
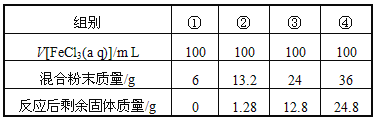
A. �������ַ�Ӧ����Һ��c��Fe3+��=2.0 mol/L
B. ������ʣ�������ͭ�������
C. �����鷴Ӧ�����Һ��c��Fe2+��=5 mol/L
D. ԭ��Ϸ�ĩ��n��Fe����n��Cu��=2��3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��ijͬѧ���һ��ȼ�ϵ�ز�̽���ȼҵԭ���ʹ�ͭ�ľ���ԭ����������װ����XΪ�����ӽ���Ĥ������Ҫ��ش�������⣺

��1������ȼ�ϵ�صĸ�����Ӧʽ______��
��2��ʯī�缫��C���ĵ缫��ӦʽΪ______��
��3�������ͭ�к���п���������ʣ���װ���з�Ӧһ��ʱ�䣬����ͭ��ҺŨ�Ƚ�______���������С�����䡱����
��4�����ڱ�״���£���2.24L�����μӷ�Ӧ������װ�������缫�����ɱ��������ĵ����Ϊ______����װ������������ͭ������Ϊ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������̿���������Ӫ��ǿ��������ýȾ����������ԭ�������̿�(MnO2)�����̿�(MnCO3)�г�������������������þ�����ʣ���������������ͼ��ʾ��
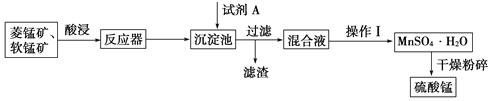
��֪����1�������̾��������þ������ܽ��������ͼ��ʾ��
��2����������ȫ������pH��Fe3��Ϊ3.5��Fe2��Ϊ9.5��Mn2��Ϊ10.8��Mg2��Ϊ11.6�������ж���ȷ����
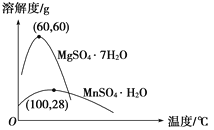
A. �Լ�AӦ��ѡ��H2O2��Ŀ���ǽ�Fe2������ΪFe3��
B. �Լ�AӦ��ѡ��ˮ��Ŀ���ǵ�����Һ��pH
C. �������������Ũ������ȴ�ᾧ�����ȹ��ˡ�ϴ�ӵȲ��裬ϴ��ʱ����ϡ������ϴ��Һ
D. ͨ��������õ�MnSO4��H2O�Ĺ����У����������ᾧ���������ᾧʱ���¶�Ӧ�ø���60 ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������пΪ��ɫ��ĩ��������ʪ�Ѣ��Ƥ���������ơ�������ҵ������п[����Fe��������Mn��������Ni������������]���������£�

��ʾ���ڱ�ʵ�������£�Ni���������ܱ�������������صĻ�ԭ������MnO2��
�ش��������⣺
��1����Ӧ���г���������������________��������Ӧ�����ӷ���ʽΪ________���ڼӸ��������Һǰ����pH�ϵͣ��Գ��ӵ�Ӱ����________��
��2����Ӧ���ķ�Ӧ����Ϊ________�����˵õ��������У����˹�����п���________��
��3����Ӧ���γɵij���Ҫ��ˮϴ����������Ƿ�ϴ�Ӹɾ��ķ�����______________��
��4����Ӧ���в���ijɷֿ�����ZnCO3��xZn��OH��2��ȡ�������˱�11.2 g�����պ�ɵõ���Ʒ8.1 g����x����________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ˮ����ȡ���д��������Һ����Ҫ�����Һ��HClO���ʵ���Ũ������Ҫ������Һ��HClŨ�������д�ʩ���Բ��õ���
A. ���Ȼӷ�HCl
B. ��ˮʹƽ��������Ӧ�����ƶ�
C. ��ͨ������
D. ��CaCO3�к�HCl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����仯ѧ�����ս����̿�(��Ҫ�ɷ�ΪMnO2)��Ũ�����ϼ��ȣ��������������Ƶ�����������ͼ��ij�о���ѧϰС�������ȡ������������Ϊ��Ӧ������ض���Ӧ��װ�á�
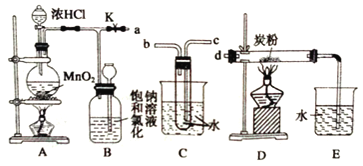
��1��A��Բ����ƿ�ڷ�����Ӧ�����ӷ���ʽ��_____________________________________��
��2��Ҫ��Cװ�ý���B��D֮�䣬��ȷ�Ľӷ���a��_____��_____��d��
��3��ʵ�鿪ʼ�ȵ�ȼA���ľƾ��ƣ�����K����Cl2��������װ�ã��ٵ�ȼD���ľƾ��ơ�Cl2ͨ��Cװ�ú����D��Dװ����ʢ��̿�ۣ�����������ԭ��Ӧ������CO2��HCl(g)��������Ӧ�Ļ�ѧ����ʽΪ________________________��Ϊ��ʹCװ�÷��Ӹ��õ����ã������ձ��м���Ũ���ᣬ����Ũ�����������___________________________________��
��4��D����Ӧ��Ϻرռ���K����ȥ�����ƾ��ƣ��������ȵ����ã�A����������Cl2��������ʱB�е�������___________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com