
【题目】某无色工业废水中可能含有Na+、Mg2+、Al3+、Cl-、SO42-中的几种离子。
a.取少许该废水于试管中,加入足量的Ba(NO3)2溶液和稀硝酸,产生白色沉淀,充分反应后过滤,向滤液中加入AgNO3溶液无沉淀产生。
b.另取10mL该废水于试管中,滴加NaOH溶液先产生白色沉淀,后部分沉淀溶解生成沉淀的物质的量随加入NaOH的物质的量关系如下图所示。
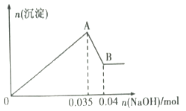
根据上述实验和图中数据:
(1)该废水中一定不含有的离子有________(填离子符号);
(2)A点沉淀的化学式___________________;
(3)写出A→B过程中发生反应的离子方程式:____________________________;
(4)该废水中,c(Al3+)=________;
【答案】Cl- Mg(OH)2 Al(OH)3 Al(OH)3 + OH- = AlO2- + H2O 0.5mol/L
【解析】
取少许该废水于管中,加入足量的Ba(NO3)2溶液和稀硝酸,产生白色沉淀,该沉淀为硫酸钡,则原溶液中含有SO42-;充分反应后过滤,向滤液中加入AgNO3溶液无沉淀产生,说明原溶液中不存在Cl-;另取10mL该废水于管中,滴加NaOH溶液先产生白色沉淀,后部分沉淀溶解,溶解的沉淀为氢氧化铝,不溶的沉淀为氢氧化镁,则原溶液中一定含有Mg2+、Al3+,钠离子不能确定。
(1)根据以上分析可知该废水中一定不含有的离子是Cl-;答案:Cl-。
(2)O→A过程中Mg2+、Al3+与氢氧化钠反应,发生反应的离子方程式为Al3++3OH-= Al(OH)3![]() +H2O;Mg2++2OH-= Mg(OH)2
+H2O;Mg2++2OH-= Mg(OH)2![]() ,所以A点沉淀的化学式Mg(OH)2
,所以A点沉淀的化学式Mg(OH)2![]() 、Al(OH)3。答案:Mg(OH)2
、Al(OH)3。答案:Mg(OH)2![]() 、Al(OH)3。
、Al(OH)3。
(3)A→B的过程中是氢氧化铝溶解,继续加氢氧化钠,发生反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O;答案:Al(OH)3+OH-=AlO2-+2H2O。
(4)根据反应Al(OH)3+OH-=AlO2-+2H2O可知n[Al(OH)3]=n(NaOH)=0.04mol-0.035mol=0.005mol,根据离子守恒可知原溶液中铝离子的物质的量为0.005mol,则原溶液中铝离子的浓度为:0.005mol÷0.01L=0.5mol/L;答案:0.5mol/L。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】将NaC1O3和NaI按物质的量之比1:1混合于烧瓶中,滴入适量硫酸,并水浴加热,反应后测得NaC1O3和NaI恰好完全反应,生成I2、Na2SO4和H2O,并产生棕黄色的气体X,则X为
A. Cl2 B. Cl2O C. Cl2O3 D. ClO2
【答案】D
【解析】试题分析:根据转移电子数守恒得,1molNaI中的碘元素由-1价生成单质碘,化合价升高转移1mol电子,故NaClO3中的氯元素化合价降低转移1mol电子,故X气体中氯元素的价态为+4价,答案选D.
考点:氧化还原反应
【题型】单选题
【结束】
25
【题目】把4.48LCO2通过一定量的固体过氧化钠后收集到3.36L气体(气体的测量均在标准状况下),所得气体的总质量是
A. 3.2g B. 4.8g C. 5.4g D. 6g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锰可用于饮料营养强氧化剂和媒染剂。其生产原材料软锰矿(MnO2)、菱锰矿(MnCO3)中常混有硫酸亚铁和硫酸镁等杂质,生产工艺流程如图所示:
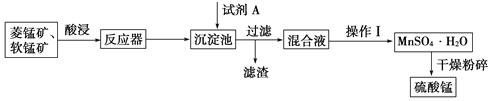
已知:(1)硫酸锰晶体和硫酸镁晶体的溶解度曲线如图所示。
(2)各离子完全沉淀的pH:Fe3+为3.5,Fe2+为9.5,Mn2+为10.8,Mg2+为11.6。下列判断正确的是
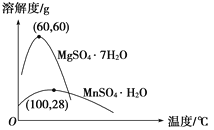
A. 试剂A应该选择H2O2,目的是将Fe2+氧化为Fe3+
B. 试剂A应该选择氨水,目的是调节溶液的pH
C. 操作Ⅰ包括蒸发浓缩、冷却结晶、趁热过滤、洗涤等步骤,洗涤时可用稀硫酸作洗涤液
D. 通过操作Ⅰ得到MnSO4·H2O的过程中,包括蒸发结晶,在蒸发结晶时,温度应该高于60 ℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在20ml 0.1mol·L-1NaOH溶液中逐滴加入0.2mol·L-1醋酸溶液,滴定曲线如图所 示,有关粒子浓度的关系中,不正确的是( )

A. 在A点:c(Na+)﹥c(OH-)﹥c(CH3COO-)﹥c(H+)
B. 在B点:c(Na+) ﹦c(CH3COO-) ﹥c(OH-)﹦c(H+)
C. 在C点:c(CH3COO-)﹥c(Na+)﹥c(H+) ﹥c(OH-)
D. 在C点:c(CH3COO-)+c(CH3COOH)﹦2 c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用氯水来制取含有次氯酸的溶液,既要提高溶液中HClO物质的量浓度,又要降低溶液中HCl浓度,下列措施可以采用的是
A. 加热挥发HCl
B. 加水使平衡向正反应方向移动
C. 再通入氯气
D. 加CaCO3中和HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下右图所示的装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶。则a和b不满足题目要求的是
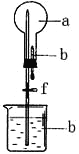
选项 | a(干燥气体) | b(液体) |
A | Cl2 | 饱和NaOH溶液 |
B | SO2 | 4mol/LNaOH溶液 |
C | NO2 | 水 |
D | NH3 | 1mol/L盐酸 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值,下列有关叙述错误的是
A. 5.6g Fe溶于过量硝酸,电子转移数目为0.3NA
B. 标准状况下,11.2L的SO3与足量水充分反应生成的溶液中H+的总数为NA
C. 由Na2O2和Na2O组成的混合物共l mol,其中阴离子数为NA
D. 3molNO2气体溶于足量水中充分反应转移的电子总数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将12.8g铜片加入到100ml一定浓度的硝酸溶液中,铜片完全溶解,产生NO和NO2的混合气体4.48L(标准状况下);若向反应后的溶液中加入400ml、2mol/L NaOH溶液,能使溶液中的Cu2+恰好完全沉淀。下列说法不正确的是
A. 反应后溶液中剩余NO3-的物质的量为0.4mol
B. 原硝酸溶液的物质的量浓度为10mol/L
C. 铜片与硝酸反应过程中转移电子0.4mol
D. 混合气体中NO和NO2的体积之比为1︰1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个2 L的密闭容器中,加入4 mol A和2 mol B进行反应3A(g)+2B(g)![]() 4C(s)+2D(g)。反应一段时间后达到平衡,测得生成1.6 mol,且反应前后的压强之比为5:4(相同的温度下测量),则下列说法正确的是
4C(s)+2D(g)。反应一段时间后达到平衡,测得生成1.6 mol,且反应前后的压强之比为5:4(相同的温度下测量),则下列说法正确的是
A. 该反应的化学平衡常数表达式是![]()
B. 此时B的平衡转化率是40%
C. 增大该体系的压强,平衡向右移动,化学平衡常数增大
D. 其他条件不变时,增大B的浓度,B的平衡转化率不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com