
【题目】用一定量的铁与足量的稀H2SO4及足量的CuO制单质铜,有人设计以下两种方案:
①Fe ![]() H2
H2 ![]() Cu , ② CuO
Cu , ② CuO ![]() CuSO4
CuSO4 ![]() Cu 。
Cu 。
若实验过程中,根据一般的实验方法和实验操作规则进行操作,则对两者制得单质铜的量作比较,正确的是
A. 相等 B. ①多 C. ②多 D. 无法判断
【答案】C
【解析】
两方案中所发生的化学方程式为:①Fe+H2SO4═FeSO4+H2↑、H2+CuO ![]() Cu+H2O;
Cu+H2O;
②CuO+H2SO4═CuSO4+H2O、Fe+CuSO4═Cu+FeSO4;
②中均可完全转化,而①中氢气还原CuO,应先通入氢气排出装置中的空气,不能全部参与还原反应;
两方案中所发生的化学方程式为:①Fe+H2SO4═FeSO4+H2↑、H2+CuO ![]() Cu+H2O;
Cu+H2O;
②CuO+H2SO4═CuSO4+H2O、Fe+CuSO4═Cu+FeSO4;
②中均可完全转化,而方案①中氢气还原氧化铜实验,开始时需先通入一部分氢气,排除装置中的空气,实验结束时还要通一会氢气,以防止生成的铜被氧化,如果不考虑先通后停,相同质量的铁生成铜的质量是相同的,但是由于部分氢气被浪费,从而导致铁的质量被多消耗一部分,所以导致方案①对应的铜减少.故方案②生成的铜多,故选C;


科目:高中化学 来源: 题型:
【题目】已知四种元素A、B、C、D,其原子序数依次增大,最外层电子数依次为4、1、2、7,其中A元素原子次外层电子数为2,B、C 两元素的原子次外层电子数为8,B元素原子最外层电子数比第1层电子数少1,也比C元素原子第M层电子数少1,D元素的单质为液态非金属单质。若此四种元素均位于元素周期表前四个周期,请按要求填写下列各题:
(1)A原子的原子结构示意图为_____,D元素在元素周期表中的位置为______。
(2)B元素的最高价氧化物对应的水化物用电子式表示为______________,C、D两元素形成的化合物化学键类型为__________。
(3)请写出D元素的单质与SO2同时通入水中反应的化学方程式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某Fe 2(SO4) 3样品含有少量FeSO4杂质,为了测定该样品中铁元素的含量,设计如下实验:
Ⅰ.称取样品m g,加入稀H2SO4,后加水配制成250.00 mL溶液;
Ⅱ.取25.00 mL溶液,先加入H2O2,然后再加过量的氨水,过滤;
Ⅲ.将沉淀用蒸馏水洗涤数次后,烘干;
Ⅳ.灼烧至质量不再减少为止,得到红棕色固体,冷却后称量,质量为n g。
请根据上面操作流程,回答以下问题:
①步骤Ⅰ中称量使用的仪器是________________,配制用到的仪器有烧杯、玻璃棒、胶头滴管,还要补充的玻璃仪器是____________________。
②步骤Ⅱ中过滤用的仪器有滤纸、铁架台、铁圈和烧杯,还要补充的玻璃仪器是________;加入H2O2的主要目的是_______________________________。
③若要检验溶液中的Fe3+,则应该加入________________试剂。
④步骤Ⅲ中检验该沉淀已经洗涤干净的操作是________________。
⑤计算该样品中铁元素的质量分数的表达式是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了检验某溶液中是否含有常见的四种无机离子,某化学小组的同学进行了如下所示的实验操作。其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝。由该实验能得出的正确结论是( )

A.原溶液中一定含有SO42- B.原溶液中一定含有NH4+
C.原溶液中一定含有Cl- D.原溶液中一定含有Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置不能达到实验目的的是
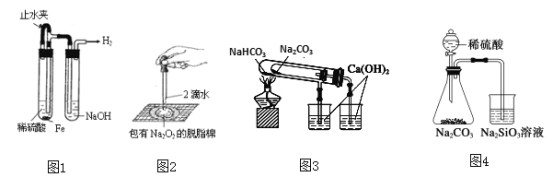
A. 图1:制备并观察氢氧化亚铁
B. 图2:证明过氧化钠与水反应放热
C. 图3:验证NaHCO3和Na2CO3的热稳定性
D. 图4:验证酸性强弱H2SO4>H2CO3>H2SiO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅是无机非金属材料的主角,硅的氧化物和硅酸盐约占地壳质量的90%以上。
(1)计算机芯片和太阳能电池的主要成分是________,光导纤维的主要成分是___________。
(2)工艺师常用氢氟酸来雕刻玻璃,该反应的化学方程式为__________。
(3)工业上可利用水玻璃和盐酸反应制备硅酸凝胶后,进一步脱水处理可得到硅胶,写出水玻璃和盐酸反应的离子方程式_______。
(4)玉石的主要成分基本都属于硅酸盐,翡翠的主要成分为NaAlSi2O6,将其表示为氧化物形式为___。
(5)高纯度单晶硅可以按下列方法制备:
SiO2 ![]() Si(粗)
Si(粗) ![]() SiHCl3
SiHCl3 ![]() Si(纯)
Si(纯)
写出步骤①的化学方程式_______________________________________。
步骤②的产物经过冷凝后得到的SiHCl3(沸点33.0℃)中含有少量的SiCl4(沸点57.6℃),提纯SiHCl3主要操作的名称是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
![]()
① 用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
② 固定好滴定管并使滴定管尖嘴充满液体;
③ 调节液面至“0”或“0”刻度线稍下,并记下读数;
④ 移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤ 用标准液滴定至终点,记下滴定管液面读数。
请回答:
(1)以上步骤有误的是(填编号)____,若测定结果偏高,其原因可能是______.
A.配制标准溶液的固体NaOH中混有KOH杂质
B.滴定终点读数时,仰视滴定管的刻度,其他操作正确
C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗
D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
(2)判断滴定终点的现象是____________________________。
(3)如下图是某次滴定时的滴定管中的液面,其读数为________mL。
(4)根据下列数据:请计算待测盐酸溶液的浓度______mol/L。
滴定次数 | 待测体积(mL) | 标准烧碱体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.40 | 20.40 |
第二次 | 20.00 | 2.00 | 24.10 |
第三次 | 20.00 | 4.00 | 24.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由CO和H2组成的混合气体2.4g在足量的O2中充分燃烧后,将生成的所有产物通过足量的Na2O2固体,Na2O2固体增加的质量为
A. 1.2g B. 2.4 g C. 3.6![]() g D. 无法计算
g D. 无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分是Al2O3、Fe2O3、SiO2)提纯Al2O3做冶炼铝的原料,提取的操作过程可用以下流程图表示:
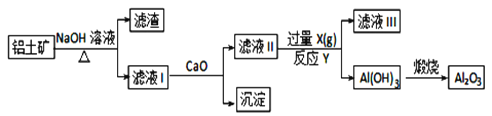
已知:Na2SiO3 + Ca(OH)2= CaSiO3↓+ 2NaOH
(1)氢氧化钠溶液浸取铝土矿时,发生反应的离子方程式有:______________________、______________________。
(2)滤液II中通入过量的气体X是________。反应的化学方程式:____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com