
����Ŀ�������ڼ��������¿ɻ�ԭ����ͭ����������ˮ�����⣬����̼�������ij��ѧС��������ͼװ��̽���䷴Ӧ���

[��������]
��CO����������Һ��Ӧ��CO��2[Ag(NH3)2]����2OH��===2Ag����2NH4+��CO32-��2NH3
��Cu2OΪ��ɫ������Ag����Ӧ���ܷ�����Ӧ��Cu2O��2H��=Cu2����Cu��H2O
��1��װ��A�з�Ӧ�Ļ�ѧ����ʽΪ________________________________________��
��2�������������װ�ô����ҵ�����˳��ΪA��____________��(����ĸ��ţ�װ�ò��ظ�ʹ��)
��3��ʵ���еμ�ϡ����IJ���Ϊ____________________________________��
��4����֪��������к���CO����װ��C�пɹ۲쵽��������____________________��װ��F������Ϊ_____________________��
��5������Ӧ������װ��D���Թ��й���ȫ����Ϊ��ɫ��
�����ʵ��֤����ɫ�����к���Cu2O��___________________________________________��
��Ϊ��֤����ɫ�������Ƿ���Cu����ͬѧ�������ʵ�飺��������ɫ�����м�������0.1mol/L AgNO3��Һ��������Һ�������ݴ��жϺ�ɫ�����к���Cu����ͬѧ��Ϊ�÷�������������֤����ͬѧ�Ľ��ۣ������������¶Ա�ʵ������ɱ������ݡ�
ʵ�鲽��(��Ҫ��д�������������) | Ԥ������ͽ��� |
______________ | ���۲쵽��Һ����������֤����ɫ�����к���Cu�����۲쵽��Һ����������֤����ɫ�����к���Cu |
���𰸡�Al4C3 + 12HCl ====3CH4�� + 4AlCl3F��D��B��E��C��G�ȴ�Һ©���Ϸ������������ò�����С�����Һ©��ͨ�����룩���ٴ��·�������ʹϡ���Ỻ�������Թܵײ��к�ɫ�������ɣ����Թ�����������������ȥ���������л��е�HCl�����ˮ����ȡ������ɫ���壬��������ϡ���ᣬ����Һ��Ϊ��ɫ����֤����ɫ�����к���Cu2Oȡ��������Cu2O�������Թ��У���������0.1 mol��L��1AgNO3��Һ
��������
װ��A�з�Ӧ��ϡ�����Al4C3��Ӧ�����Ȼ����ͼ��飬�����ڼ��������¿ɻ�ԭ����ͭ����������ˮ�����⣬����̼����������ɵļ�������ͨ��װ��F���ջ��е��Ȼ��⣬�������壬ͨ��װ��D���Ȼ�ԭ����ͭ��ͨ��װ��B�������ɵ�ˮ������ͨ��װ��E�����������ɲ��������̼��ͨ��װ��C��������Һ��֤һ����̼��CO����������Һ��Ӧ��CO��2[Ag(NH3)2]����2OH��===2Ag����2NH4+��CO32-��2NH3���������ˮ�����պ��ռ�β����
��1��װ��A�з�Ӧ��ϡ�����Al4C3��Ӧ�����Ȼ����ͼ��飬��Ӧ�Ļ�ѧ����ʽΪ��Al4C3+12HCl=3CH4 ��+4AlCl3���ʴ�Ϊ��Al4C3+12HCl=3CH4 ��+4AlCl3��
��2��װ��A�з�Ӧ��ϡ�����Al4C3��Ӧ�����Ȼ����ͼ��飬�����ڼ��������¿ɻ�ԭ����ͭ����������ˮ�����⣬����̼����������ɵļ�������ͨ��װ��F���ͨ��װ��D���Ȼ�ԭ����ͭ��ͨ��װ��B�������ɵ�ˮ������ͨ��װ��E�����������ɲ��������̼��ͨ��װ��C��������Һ��֤һ����̼��CO����������Һ��Ӧ��CO��2[Ag(NH3)2]����2OH��===2Ag����2NH4+��CO32-��2NH3���������ˮ�����պ��ռ����壬�����������װ�ô����ҵ�����˳��ΪA��F��D��B��E��C��G���ʴ�Ϊ��F��D��B��E��C��G��
��3��ʵ���еμ�ϡ����IJ����ǣ��ȴ�Һ©���ϿڵIJ����������Ƚ���Һ©���ϿڵIJ������ϵİ��۶�©���ϵ�С�ף����ٽ���Һ©�������������ʹϡ���Ỻ�����£��ʴ�Ϊ���ȴ�Һ©���ϿڵIJ����������Ƚ���Һ©���ϿڵIJ������ϵİ��۶�©���ϵ�С�ף����ٽ���Һ©�������������ʹϡ���Ỻ�����£�
��4�����庬��һ����̼��C��������Һ��һ����̼��ԭ���������ʣ��Թ����к�ɫ�������ɣ�F�dz�ȥ���������������Ȼ����ˮ�������ʴ�Ϊ���Թ����к�ɫ�������ɣ���ȥ�����е�HCl��H2O��
��5������Ӧ������װ��D���Թ��й���ȫ����Ϊ��ɫ��
��ʵ��֤����ɫ�����к���Cu2O�ķ���Ϊ��ȡ������ɫ���壬��������ϡ���ᣬ����Һ����ɫ��˵����ͭ���ӣ���֤����Cu2O���ʴ�Ϊ��ȡ������ɫ���壬��������ϡ���ᣬ����Һ����ɫ����֤����Cu2O��
����֤����ɫ�������Ƿ���Cu����ͬѧ�������ʵ�飺��������ɫ�����м���������0.1mol/LAgNO3��Һ��������Һ�������ݴ��жϺ�ɫ�����к���Cu����ͬѧ��Ϊ�÷�������������֤����ͬѧ�Ľ��ۣ�����Ҫ���ӶԱ�ʵ�飺ȡ������Cu2O�������Թ��У�����������0.1mol/LAgNO3��Һ������Һ��������������ų���ɫ������������ͭ�ĸ��ţ�֤�����к�ͭ���ʴ�Ϊ��ȡ������Cu2O�������Թ��У�����������0.1mol/LAgNO3��Һ��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����������(FexO)1.52 g�������������У���������Һ��ͨ���״����112 mL Cl2��ǡ�ý�Fe2+��ȫ����������˵����ȷ����(����)
A. FexO�������������ֻ������FeCl3��H2O
B. ��״����112 mL Cl2�����ʵ�����5 mol
C. x=0.8
D. ͨ��Cl2������Ӧ�����ӷ���ʽ��Fe2++Cl2![]() Fe3++2Cl��
Fe3++2Cl��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�����ڱ��ж����ڵ�һ���֣�A��B��C����Ԫ�ص�ԭ�Ӻ��������֮�͵���B����������BԪ�ص�ԭ�Ӻ�������������������������������ȷ����( )

A. BΪ�ڶ����ڵ�Ԫ��
B. CΪVA��Ԫ��
C. ����Ԫ�ض�Ϊ�ǽ���Ԫ��
D. B�������л�ѧ��������õķǽ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��CΪ��ѧ�������ʣ�����һ��Ϊ������ͨ�������AΪ���塢BΪ����ɫ���塢CΪ��ɫ���塣D��E��F��G��H��X��Ϊ���������X����������ɫ���壬��ˮ��Һ��һ������ǿ����Һ��EΪ��ɫ���壬H�ڳ�����ΪҺ�塣����֮���ת����ϵ��ͼ��ʾ������ijЩ��Ӧ�����Ͳ��ַ�Ӧ��������ȥ����
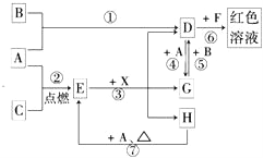
��1��д���������ʵĻ�ѧʽ��D___________��X_______________��
��2���ڷ�Ӧ�١����У�������������ԭ��Ӧ����_____________�����ţ���
��3����Ӧ�����ӷ���ʽΪ��______________________________________��
��4����G��Һ�м���NaOH��Һ�۲쵽��������________________________��
��5����Ӧ�ߵĻ�ѧ����ʽΪ____________________________________���÷�Ӧ��ÿ����0.3mol��A����ת�Ƶ���________mol��
��6����ȥD��Һ�л��е�����G�Ļ�ѧ����ʽ��_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ú��ʯ���п�������������ԭ��A��B��A��һ�ֹ�ʵ����������IJ�����������һ�����ҵ�ʯ�ͻ�����չˮƽ��B��һ�ֱ�ˮ�����״Һ�壬B����̼������Ԫ����ɣ�̼Ԫ������Ԫ�ص�������Ϊ12:1��B����Է�������Ϊ78���ش��������⣺
(1)A�ĵ���ʽ_______��B�Ľṹ��ʽ_____________________��
(2)��A���ڵ�ͬϵ��Cʹ������Ȼ�̼��Һ��ɫ�Ļ�ѧ��Ӧ����ʽ��___________________��
(3)�ڵ�ˮ�м���B���ú������________________��
(4)B��Ũ�����Ũ������50��60�淴Ӧ�Ļ�ѧ��Ӧ����ʽ��_____________________________����Ӧ���ͣ�________��
(5)��������A��B��ȫȼ��ʱ����O2�����ʵ���________(��A>B��A<B��A��B��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�˵������ȷ����
A. 12C��13C��14C��̼������ͬ��������
B. H2S�ĵ���ʽ�ɱ�ʾΪ![]()
C. HCl��HBr��HI���ȶ������������۷е�������
D. NaHSO4������״̬�²����ƻ������Ӽ������ƻ��˹��ۼ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ���ǣ� ��
A. �ñ��Ӷ���ʢ��������ƿ�ڣ��Ϳ����ᵽ��������ζ B. ������Ư����
C. ����ˮ������������ռ������������� D. ����ˮ����������ɱ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���20 mL 0.1mol/L��K2CO3��Һ����μ���0.1mol/L��ϡ����40mL����Һ�к�̼Ԫ�صĸ�����(CO2���ݳ�δ����)�����ʵ�����������ҺpH�仯���������ͼ��ʾ������˵����ȷ����
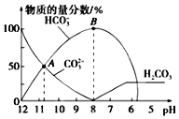
A. ����ϡ����ļ��룬��Һ��c(HCO3��)��c(OH��)/c(CO32��)���ֲ���
B. ����A����㣬Ka2(H2CO3)��������Ϊ10-3
C. B����������Һ�У�c(K+)+c(H+)=2c(CO32��)+c(HCO3��)+c(OH��)
D. ��pHԼΪ8ʱ����Һ�п�ʼ�ų�CO2����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Cl2��H2O=HCl��HClO�У�ˮ��(����)
A.ֻ��������B.ֻ����ԭ��
C.����������������ԭ��D.�Ȳ����������ֲ��ǻ�ԭ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com