
【题目】常温下,向20 mL 0.1mol/L的K2CO3溶液中逐滴加入0.1mol/L的稀盐酸40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)的物质的量分数随溶液pH变化的情况如下图所示。下列说法正确的是
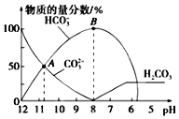
A. 随着稀盐酸的加入,溶液中c(HCO3-)·c(OH-)/c(CO32-)保持不变
B. 根据A点计算,Ka2(H2CO3)的数量级为10-3
C. B点所处的溶液中:c(K+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
D. 当pH约为8时,溶液中开始放出CO2气体
【答案】A
【解析】
A.c(HCO3-)·c(OH-)/c(CO32-)=c(HCO3-)·c(OH-)·c(H+)/c(CO32-)·c(H+)=Kw/Ka2,平衡常数不随浓度变化,随着盐酸的加入,溶液中c(HCO3-)·c(OH-)/c(CO32-)保持不变,A正确;
B.A点溶液中c(CO32-)=c(HCO3-),pH≈11,即氢离子浓度约是10-11mol/L,则Ka2=c(CO32-)·c(H+)/c(HCO3-)=c(H+)≈10-11mol/L,即Ka2(H2CO3)的数量级为10-11,B错误;
C.任何电解质溶液中都存在电荷守恒,根据电荷守恒得B点所处的溶液中c(K+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)+c(Cl-),C错误;
D.根据图像可知pH=6时,氢离子与碳酸氢根离子反应有CO2气体逸出,当pH约为8时,恰好转化为碳酸氢钾,D错误。
答案选A。


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:
【题目】已知:一个碳原子上连多个羟基时不稳定:
芳香烃A有如图的转化关系:
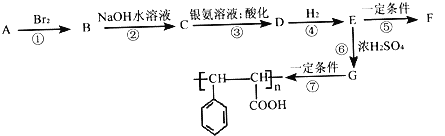
(1)已知1molA能与2molBr2加成,写出A的结构简式___________________;写出B的分子式___________________。
(2)D中含氧官能团的名称为______________,指出反应⑥的反应类型:___________________。
(3)写出C与银氨溶液反应的化学方程式:_________________________________。
(4)E有多种同分异构体,符号下列条件的共有__________种。
①属于芳香化合物; ②能使FeCl3溶液发生显色反应;
③含有酯的结构; ④苯环上有两个取代基。
其中核磁共振氢谱中有6组吸收峰,其面积之比为1∶2∶2∶2∶2∶1的有机物结构简式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷在加热条件下可还原氧化铜,气体产物除水蒸气外,还有碳的氧化物。某化学小组利用如图装置探究其反应产物。

[查阅资料]
①CO能与银氨溶液反应:CO+2[Ag(NH3)2]++2OH-===2Ag↓+2NH4++CO32-+2NH3
②Cu2O为红色,不与Ag+反应,能发生反应:Cu2O+2H+=Cu2++Cu+H2O
(1)装置A中反应的化学方程式为________________________________________。
(2)按气流方向各装置从左到右的连接顺序为A→____________。(填字母编号,装置不重复使用)
(3)实验中滴加稀盐酸的操作为____________________________________。
(4)已知气体产物中含有CO,则装置C中可观察到的现象是____________________;装置F的作用为_____________________。
(5)当反应结束后,装置D处试管中固体全部变为红色。
①设计实验证明红色固体中含有Cu2O:___________________________________________。
②为了证明红色固体中是否含有Cu,甲同学设计如下实验:向少量红色固体中加入适量0.1mol/L AgNO3溶液,发现溶液变蓝,据此判断红色固体中含有Cu。乙同学认为该方案不合理,欲证明甲同学的结论,还需增加如下对比实验,完成表中内容。
实验步骤(不要求写出具体操作过程) | 预期现象和结论 |
______________ | 若观察到溶液不变蓝,则证明红色固体中含有Cu;若观察到溶液变蓝,则不能证明红色固体中含有Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1 mol·L-1的三种酸(HA、HB和HD)溶液,滴定曲线如图所示,下列判断错误的是 ( )
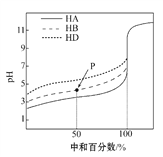
A. 三种酸的电离常数关系:KHA>KHB>KHD
B. pH=7时,三种溶液中:c(A-)=c(B-)=c(D-)
C. 滴定至P点时,溶液中:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)
D. 当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)= c(OH-)-c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在做氨的催化氧化实验时,铂丝不能接触氨水,原因是( )
A.铂丝温度高,接触氨水会使氨气大量逸出
B.防止铂丝温度降低而不能起催化作用
C.红热铂丝会与氨水反应,使铂丝腐蚀
D.防止爆炸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在研究Fe与H2SO4的反应时,进行了如下实验。
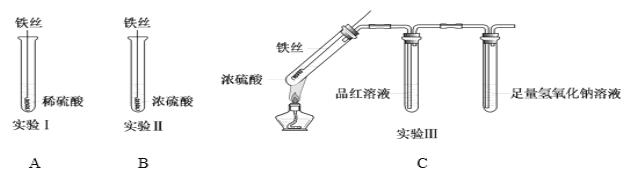
(1)实验Ⅰ中,铁与稀硫酸反应的离子方程式为__________________________________。
(2)实验Ⅱ中,铁丝表面迅速变黑,反应很快停止,其原因是________________________________。
(3)实验Ⅲ中,加热后产生大量气体,中间试管中品红溶液的红色褪去,最终未检测到可燃性气体。最后装NaOH溶液试管中反应的离子方程式是_________________________________。
(4)对比实验Ⅰ、Ⅱ和Ⅲ,同学们得出以下结论:
①浓硫酸和稀硫酸都具有氧化性,但原因不同。浓硫酸的氧化性源于+6价的硫元素,稀硫酸的氧化性源于______。
②造成反应多样性的主要因素有________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水是生命之源,它与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。
(1)水分子中氧原子在基态时核外电子排布式为________________________;
(2)写出与H2O分子互为等电子体的微粒___________________(填1种即可)。
(3)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是___________________
A.氧原子的杂化类型发生了改变 B.微粒的形状发生了改变
C.微粒的化学性质发生了改变 D.微粒中的键角发生了改变
(4)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是___________________(请用相应的编号填写)

(5)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51 kJ/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能”是_________kJ/mol;
(6)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子。请写出生成此配合离子的离子方程式:____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组为了探究一种无机矿物盐X(仅含四种元素)的组成和性质,设计并完成了如下实验:

另取10.80 g X在惰性气流中加热至完全分解,得到6.40 g固体1。请回答如下问题:
(1)画出白色沉淀1中金属元素的原子结构示意图:________________。写出气体甲的电子式:________。
(2)X的化学式是________,在惰性气流中加热X至完全分解的化学方程式为____________。
(3)白色沉淀2在空气中变成红褐色沉淀的原因是______________________________(用化学反应方程式表示)。
(4)一定条件下,气体甲与固体1中的某种成分可能发生氧化还原反应,写出一个可能的化学反应方程式:___________,并设计实验方案验证该反应的产物:______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com