
【题目】某研究小组为了探究一种无机矿物盐X(仅含四种元素)的组成和性质,设计并完成了如下实验:

另取10.80 g X在惰性气流中加热至完全分解,得到6.40 g固体1。请回答如下问题:
(1)画出白色沉淀1中金属元素的原子结构示意图:________________。写出气体甲的电子式:________。
(2)X的化学式是________,在惰性气流中加热X至完全分解的化学方程式为____________。
(3)白色沉淀2在空气中变成红褐色沉淀的原因是______________________________(用化学反应方程式表示)。
(4)一定条件下,气体甲与固体1中的某种成分可能发生氧化还原反应,写出一个可能的化学反应方程式:___________,并设计实验方案验证该反应的产物:______。
【答案】)
![]() CaFe(CO3)2CaFe(CO3)2
CaFe(CO3)2CaFe(CO3)2![]() CaO+FeO+2CO2↑4Fe(OH)2+2H2O+O2=4Fe(OH)32FeO+CO2
CaO+FeO+2CO2↑4Fe(OH)2+2H2O+O2=4Fe(OH)32FeO+CO2![]() Fe2O3+CO检测Fe2O3:将固体用稀盐酸溶解,加入KSCN溶液若显红色,表明产物中有Fe(Ⅲ);检测CO:将气体通过灼热CuO,黑色固体变红色
Fe2O3+CO检测Fe2O3:将固体用稀盐酸溶解,加入KSCN溶液若显红色,表明产物中有Fe(Ⅲ);检测CO:将气体通过灼热CuO,黑色固体变红色
【解析】
因X与盐酸反应生成气体甲,则X应为弱酸盐,又因X受热分解可生成气体甲和固体1,可推知固体1应为金属氧化物。因固体1中有与水反应的物质,且溶液1中通入气体甲先出现白色沉淀1后溶解,可推知固体1中含有CaO,气体甲为CO2。根据白色沉淀2遇到空气变为红褐色沉淀,可知X中含有Fe2+。综上分析,X应含有FeCO3和CaCO3。 (1)白色沉淀1为CaCO3,钙原子的结构示意图为 ;CO2为共价化合物,C、O原子间以共价键结合,其电子式为
;CO2为共价化合物,C、O原子间以共价键结合,其电子式为![]() ; (2)10.80 g X完全分解生成CO2的质量为10.80 g-6.40 g=4.40 g,其物质的量为0.10 mol,根据CaCO3
; (2)10.80 g X完全分解生成CO2的质量为10.80 g-6.40 g=4.40 g,其物质的量为0.10 mol,根据CaCO3![]() CaO+CO2↑、FeCO3
CaO+CO2↑、FeCO3![]() FeO+CO2↑可得:n(FeO)+n(CaO)=0.1 mol,56 g·mol-1×n(CaO)+72 g·mol-1×n(FeO)=6.40 g,解以上两式可得:n(FeO)=n(CaO)=0.050 mol,则X的化学式为CaFe(CO3)2。X在惰性气流中受热至完全分解的化学方程式为CaFe(CO3)2
FeO+CO2↑可得:n(FeO)+n(CaO)=0.1 mol,56 g·mol-1×n(CaO)+72 g·mol-1×n(FeO)=6.40 g,解以上两式可得:n(FeO)=n(CaO)=0.050 mol,则X的化学式为CaFe(CO3)2。X在惰性气流中受热至完全分解的化学方程式为CaFe(CO3)2![]() CaO+FeO+2CO2↑。 (3)Fe(OH)2被空气中的O2氧化为Fe(OH)3,其化学方程式为4Fe(OH)2+2H2O+O2===4Fe(OH)3。(4)高温下FeO与CO2反应生成CO,另一种产物可能是Fe2O3。将反应后所得到的固体用稀硫酸溶解,然后用KSCN溶液检验是否含有Fe3+,将气体产物通过热的CuO固体,根据固体变红色可确定CO2中有CO。检测Fe2O3:将固体用稀盐酸溶解,加入KSCN溶液若显红色,表明产物中有Fe(Ⅲ);检测CO:将气体通过灼热CuO,黑色固体变红色。
CaO+FeO+2CO2↑。 (3)Fe(OH)2被空气中的O2氧化为Fe(OH)3,其化学方程式为4Fe(OH)2+2H2O+O2===4Fe(OH)3。(4)高温下FeO与CO2反应生成CO,另一种产物可能是Fe2O3。将反应后所得到的固体用稀硫酸溶解,然后用KSCN溶液检验是否含有Fe3+,将气体产物通过热的CuO固体,根据固体变红色可确定CO2中有CO。检测Fe2O3:将固体用稀盐酸溶解,加入KSCN溶液若显红色,表明产物中有Fe(Ⅲ);检测CO:将气体通过灼热CuO,黑色固体变红色。


科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.1mol/L的K2CO3溶液中逐滴加入0.1mol/L的稀盐酸40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)的物质的量分数随溶液pH变化的情况如下图所示。下列说法正确的是
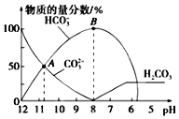
A. 随着稀盐酸的加入,溶液中c(HCO3-)·c(OH-)/c(CO32-)保持不变
B. 根据A点计算,Ka2(H2CO3)的数量级为10-3
C. B点所处的溶液中:c(K+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
D. 当pH约为8时,溶液中开始放出CO2气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C都是常见有机物,其转化关系如下(部分反应物、产物和反应条件已略去):
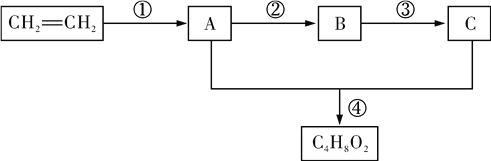
请回答下列问题:
(1)写出①的反应类型______________;
(2)写出C中官能团的名称____________;
(3)写出反应②的化学方程式________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)①Na2CO3俗称纯碱,其水溶液呈碱性,原因是________________________(用离子方程式解释);
②常温下,0.050 0 mol/L硫酸溶液的pH=__________;
③用0.010 0 mol/L氢氧化钠溶液滴定未知浓度的盐酸,酚酞作指示剂,滴定终点时,溶液的颜色由无色变为__________(填“蓝色”或“浅红色”),且半分钟内保持不变。
(2)①已知H2与O2反应生成1 mol H2O(g)时放出241.8 kJ的热量,请完成该反应的热化学方程式:2H2(g)+O2(g)===2H2O(g) ΔH=__________kJ/mol;
②已知:C(石墨,s)===C(金刚石,s) ΔH>0,则稳定性石墨比金刚石________(填“强”或“弱”)。
(3)在某恒容密闭容器中进行可逆反应FeO(s)+CO(g)=Fe(s)+CO2(g) ΔH>0,平衡常数表达式为K=![]() 。
。
①反应达到平衡后,向容器中通入CO,化学平衡向__________(填“正反应”或“逆反应”)方向移动;
②若降低温度,平衡常数K__________(填“增大”“减小”或“不变”);
③查阅资料得知1 100 ℃时K=0.263。某时刻测得容器中c(CO2)=0.025 mol/L,c(CO)=0.10 mol/L,此时刻反应__________(填“达到”或“未达到”)平衡状态。
(4)电化学是研究化学能与电能相互转化的装置、过程和效率的科学。
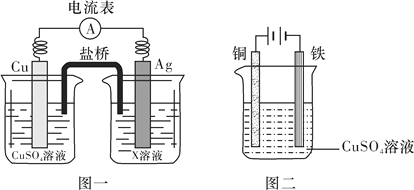
①根据氧化还原反应2Ag+(aq)+Cu(s)===2Ag(s)+Cu2+(aq),设计的原电池如图一所示,X溶液是__________(填“CuSO4”或“AgNO3”)溶液;
②图二装置在铁件上镀铜,铁作阴极,则阴极上的电极反应式是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物G(分子式为C13H18O2)是一种香料,如图是该香料的一种合成路线。

已知:
①E能发生银镜反应,在一定条件下,1 mol E能与2 mol H2反应生成F;
②R—CH===CH2![]() R—CH2CH2OH;
R—CH2CH2OH;
③有机物D的摩尔质量为88 g·mol-1,其核磁共振氢谱有3组峰;
④有机物F是苯甲醇的同系物,苯环上只有一个无支链的侧链。
回答下列问题:
(1)用系统命名法命名有机物B________________;
(2)E的结构简式为__________________________;
(3)C与新制Cu(OH)2反应的化学方程式为____________________________;
(4)已知有机物甲符合下列条件:①为芳香族化合物;②与F互为同分异构体;③能被催化氧化成醛。符合上述条件的有机物甲有________种,写出一种满足苯环上有3个侧链,且核磁共振氢谱有5组峰,峰面积比为6∶2∶2∶1∶1的有机物的结构简式____________________;
(5)以丙烯等为原料合成D的路线如下:

X的结构简式为_______,步骤Ⅱ的反应条件为___________,步骤Ⅳ的反应类型为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁、戊是中学常见的无机物,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去)。下列说法不正确的是:
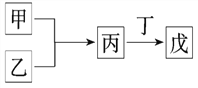
A. 若甲既能与盐酸反应又能与NaOH溶液反应,则丙可能属于两性氧化物
B. 若丙、丁混合产生白烟,且丙为18电子分子,丁为10电子分子,则乙的水溶液可能具有漂白作用
C. 若甲为短周期中原子半径最大的主族元素的单质,且戊为碱,则丙只能为Na2O2
D. 若甲、丙、戊含有同一种元素,则三种物质中,该元素的化合价由低到高的顺序可能为甲<丙<戊
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种杀菌消毒效率高、二次污染小的水处理剂,实验室中可通过以下反应制得:2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O据此,下列说法不正确的是( )
2ClO2↑+K2SO4+2CO2↑+2H2O据此,下列说法不正确的是( )
A. KClO3发生还原反应
B. H2C2O4在反应中被氧化
C. H2C2O4的氧化性强于C1O2的氧化性
D. 每1mol C1O2生成,该反应转移的电子数约为6.02×1023
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com