
【题目】A、B、C都是常见有机物,其转化关系如下(部分反应物、产物和反应条件已略去):
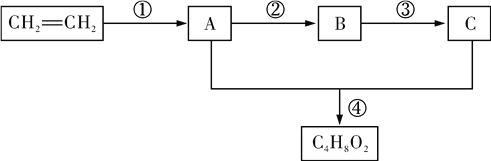
请回答下列问题:
(1)写出①的反应类型______________;
(2)写出C中官能团的名称____________;
(3)写出反应②的化学方程式________________________________________________________________________。
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:
【题目】室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1 mol·L-1的三种酸(HA、HB和HD)溶液,滴定曲线如图所示,下列判断错误的是 ( )
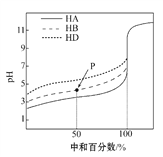
A. 三种酸的电离常数关系:KHA>KHB>KHD
B. pH=7时,三种溶液中:c(A-)=c(B-)=c(D-)
C. 滴定至P点时,溶液中:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)
D. 当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)= c(OH-)-c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水是生命之源,它与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。
(1)水分子中氧原子在基态时核外电子排布式为________________________;
(2)写出与H2O分子互为等电子体的微粒___________________(填1种即可)。
(3)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是___________________
A.氧原子的杂化类型发生了改变 B.微粒的形状发生了改变
C.微粒的化学性质发生了改变 D.微粒中的键角发生了改变
(4)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是___________________(请用相应的编号填写)

(5)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51 kJ/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能”是_________kJ/mol;
(6)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子。请写出生成此配合离子的离子方程式:____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学研究性学习小组的同学在学习了氨的性质后讨论:运用类比的思想,既然氨气具有还原性,能否像H2那样还原CuO呢?他们设计实验制取氨气并探究上述问题。请你参与该小组的活动并完成下列研究:
(一)制取氨气
(1)写出实验制取氨气的化学方程式______________________________________;
(2)在实验室中,还可以用浓氨水与____________(填写一种试剂)快速制取少量氨气;
(二)该小组中某同学设计了下图所示的实验装置(夹持及尾气处理装置未画出),探究氨气的还原性:
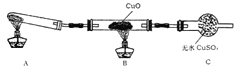
(1)该装置在设计上有一定缺陷,为保证实验结果的准确性,对该装置的改进措施是____。
(2)利用改进后的装置进行实验,观察到CuO变为红色物质,无水CuSO4变蓝色,同时生成一种无污染的气体。写出氨气与CuO反应的化学方程式:_________________________
(三)问题讨论
(1)有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O。已知:Cu2O是一种碱性氧化物;在酸性溶液中,Cu+的稳定性比Cu2+差(Cu+ ![]() Cu+Cu2+)。请你设计一个简单的实验检验该红色物质中是否含有Cu2O_______________________________________________。
Cu+Cu2+)。请你设计一个简单的实验检验该红色物质中是否含有Cu2O_______________________________________________。
(2)在解决了问题(1)后,又有同学提出:Cu2O与CuO的热稳定性哪个更强?于是他们进行了如下实验:取98 gCu(OH)2固体,加热至80℃~100℃时,得到黑色固体粉末,继续加热到1000℃以上,黑色粉末全部变为红色粉末A。冷却后称量,A的质量为72g。据此可推得,A的化学式为____________。由此,得到的结论是:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子一定能大量共存的是( )
A. 加入铝粉有氢气产生的溶液中:Na+、K+、SO42-、Cl-、HCO3-
B. 含有大量硝酸根离子的溶液中:H+、Fe2+、SO42-、Cl-
C. 常温下,![]() =1×10-10的溶液中:NH4+、K+、Ca2+、Cl-
=1×10-10的溶液中:NH4+、K+、Ca2+、Cl-
D. 常温下pH=1的溶液中:MnO4-、NO3-、SO42-、Na+、Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关胶体的叙述正确的是( )
A. 直径介于1-100nm之间的微粒称为胶体
B. 有色玻璃、雾都不是胶体
C. 涂料、颜料、墨水的制造,明矾净水和胶体有关
D. 硅酸胶体加入过量的氢氧化钠溶液由于胶体聚沉而形成硅酸沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组为了探究一种无机矿物盐X(仅含四种元素)的组成和性质,设计并完成了如下实验:

另取10.80 g X在惰性气流中加热至完全分解,得到6.40 g固体1。请回答如下问题:
(1)画出白色沉淀1中金属元素的原子结构示意图:________________。写出气体甲的电子式:________。
(2)X的化学式是________,在惰性气流中加热X至完全分解的化学方程式为____________。
(3)白色沉淀2在空气中变成红褐色沉淀的原因是______________________________(用化学反应方程式表示)。
(4)一定条件下,气体甲与固体1中的某种成分可能发生氧化还原反应,写出一个可能的化学反应方程式:___________,并设计实验方案验证该反应的产物:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式是( )
A. 大理石溶于醋酸中:CaCO3+2H+═Ca2++CO2↑+H2O
B. 向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+═2Fe(OH)3+3Mg2+
C. MnO2与浓盐酸反应制Cl2:MnO2+4H++4Cl﹣![]() Mn2++2Cl2↑+2H2O
Mn2++2Cl2↑+2H2O
D. 浓硝酸中加入过量铁粉并加热:Fe+3NO3﹣+6H+![]() Fe3++3NO2↑+3H2O
Fe3++3NO2↑+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氯酸钾和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯,其化学方程式为:2KClO3+4HCl(浓)═2KCl+2ClO2↑+Cl2↑+2H2O
①用单线桥表示上述反应中电子转移的方向和数目_____________________;
②浓盐酸在该反应中表现的性质是______(填序号);
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
③该反应的还原产物是______________(填化学式);
④上述反应产生0.1 mol Cl2时,转移电子的物质的量为______________。
(2)实验室可以用高锰酸钾和浓盐酸反应制取氯气,反应的化学方程式为:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
①在该反应中,氧化剂与还原剂的物质的量之比是_________________;
②KMnO4的氧化性比Cl2的氧化性______________;
③若在反应中生成了标况下2.24L氯气,则电子转移的个数是______NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com