
【题目】(1)氯酸钾和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯,其化学方程式为:2KClO3+4HCl(浓)═2KCl+2ClO2↑+Cl2↑+2H2O
①用单线桥表示上述反应中电子转移的方向和数目_____________________;
②浓盐酸在该反应中表现的性质是______(填序号);
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
③该反应的还原产物是______________(填化学式);
④上述反应产生0.1 mol Cl2时,转移电子的物质的量为______________。
(2)实验室可以用高锰酸钾和浓盐酸反应制取氯气,反应的化学方程式为:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
①在该反应中,氧化剂与还原剂的物质的量之比是_________________;
②KMnO4的氧化性比Cl2的氧化性______________;
③若在反应中生成了标况下2.24L氯气,则电子转移的个数是______NA
【答案】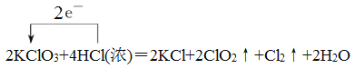 B ClO2 0.2 mol 1:5 强 0.2
B ClO2 0.2 mol 1:5 强 0.2
【解析】
(1)①根据反应中氯元素的化合价变化情况解答;
②HCl中Cl元素的化合价升高,具有还原性,生成盐表现酸性;
③得到电子的元素被还原,得到还原产物;
④根据反应中氯元素的化合价变化计算;
(2)①分析方程式中元素化合价变化判断氧化剂及还原剂;
②依据氧化还原反应中:氧化剂氧化性大于氧化产物氧化性解答;
③依据方程式判断元素的化合价变化计算转移电子数。
(1)①KClO3中Cl元素由+5价降低为+4价,HCl中Cl元素由-1价升高为0,反应中转移2e-,则单线桥表示反应中电子转移的方向和数目为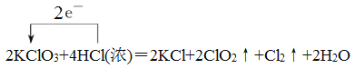 ;
;
②由反应可知,HCl中部分Cl元素的化合价升高,体现还原性,部分化合价不变生成盐表现酸性,故答案为B;
③KClO3中Cl元素由+5价降低为+4价,得到电子,被还原,所以该反应的还原产物是ClO2;④反应可知,生成1molCl2时,转移2mol电子,则产生0.1molCl2时,转移电子的物质的量为0.2mol;
(2)①反应2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O中,通过化合价升降判断,Mn元素由+7价降低到+2价,Cl元素的化合价由-1价升高到0,2mol高锰酸钾得电子是氧化剂,10molHCl失电子是还原剂,所以氧化剂与还原剂的物质的量之比是2:10=1:5;
②反应2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O中高锰酸钾为氧化剂,氯气为氧化产物,依据氧化剂氧化性大于氧化产物氧化性,所以高锰酸钾氧化性强于氯气;
③依据方程式2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O可知:生成5mol氯气转移10mol电子,则转移2mol电子,生成1mol氯气,标况下2.24L氯气是0.1mol,则电子转移的个数是0.2NA。


科目:高中化学 来源: 题型:
【题目】A、B、C都是常见有机物,其转化关系如下(部分反应物、产物和反应条件已略去):
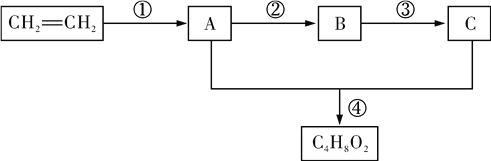
请回答下列问题:
(1)写出①的反应类型______________;
(2)写出C中官能团的名称____________;
(3)写出反应②的化学方程式________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁、戊是中学常见的无机物,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去)。下列说法不正确的是:
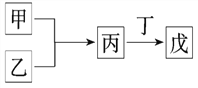
A. 若甲既能与盐酸反应又能与NaOH溶液反应,则丙可能属于两性氧化物
B. 若丙、丁混合产生白烟,且丙为18电子分子,丁为10电子分子,则乙的水溶液可能具有漂白作用
C. 若甲为短周期中原子半径最大的主族元素的单质,且戊为碱,则丙只能为Na2O2
D. 若甲、丙、戊含有同一种元素,则三种物质中,该元素的化合价由低到高的顺序可能为甲<丙<戊
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究小组用下图装置制取Cl2,证明产生的气体中含有HCl。
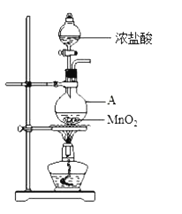
(1)仪器A的名称为________;A中反应的离子方程式为________。
(2)甲同学将A中产生的气体通入下列溶液:
实验序号 | 试剂 | 现象 |
a | 紫色石蕊溶液 | |
b | AgNO3溶液 | 出现白色沉淀 |
①实验a中的现象为________。
②不能证明产生的气体中含有HCl的实验是________(填字母序号)。
(3)已知将HCl气体通入饱和食盐水中有白色固体析出。乙同学将A中产生的气体通入饱和食盐水中,有白色固体析出,但该实验不能证明气体中含有HCl,结合化学用语解释其原因:______________________________________。
(4)已知:2S2O32-+I2=== S4O62-+2I-。丙同学将A中产生的气体通入蒸馏水中,得到溶液X,进行以下实验证明气体中含有HCl。
I.测定X中溶解的Cl2。取25.00 mL溶液X,加入过量KI溶液,然后用0.04 molL-1 Na2S2O3溶液滴定生成的I2,达滴定终点时消耗Na2S2O3溶液V mL。
II.测定X中Cl元素总量。另取25.00 mL溶液X,选用适当的还原剂将溶解的Cl2全部还原为Cl-,再用0.10 molL-1 AgNO3溶液滴定所得溶液中的Cl-。
①X中的HClO不会影响I的测定结果,原因是________。
②由I、II 中实验数据可证明A中产生的气体中含有HCl,则II中消耗0.10 molL-1 AgNO3溶液的体积应大于________mL(用含V的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表达下列反应的离子方程式为
A. 用醋酸除去水垢:2H++CaCO3=Ca2++CO2↑+H2O
B. 硫化亚铁与浓硫酸混合加热:2H++FeS=H2S↑+ Fe2+
C. 向硫酸铝溶液中滴加碳酸钠溶液:2Al3++3![]() =Al2(CO3)3↓
=Al2(CO3)3↓
D. 用氢氧化钠溶液吸收工业废气中的NO2:2NO2+2OH-=![]() +
+![]() + H2O
+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生下列反应aA(g) ![]() cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
A. A的转化率变大
B. 平衡向正反应方向移动
C. D的体积分数变大
D. a < c+d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种杀菌消毒效率高、二次污染小的水处理剂,实验室中可通过以下反应制得:2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O据此,下列说法不正确的是( )
2ClO2↑+K2SO4+2CO2↑+2H2O据此,下列说法不正确的是( )
A. KClO3发生还原反应
B. H2C2O4在反应中被氧化
C. H2C2O4的氧化性强于C1O2的氧化性
D. 每1mol C1O2生成,该反应转移的电子数约为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下硝酸铵受热分解的化学方程式为:5NH4NO3![]() 2HNO3+4N2+9H2O,在反应中被氧化与被还原的氮原子数之比为( )
2HNO3+4N2+9H2O,在反应中被氧化与被还原的氮原子数之比为( )
A. 5∶3 B. 5∶4 C. 1∶1 D. 3∶5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com