
【题目】水是生命之源,它与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。
(1)水分子中氧原子在基态时核外电子排布式为________________________;
(2)写出与H2O分子互为等电子体的微粒___________________(填1种即可)。
(3)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是___________________
A.氧原子的杂化类型发生了改变 B.微粒的形状发生了改变
C.微粒的化学性质发生了改变 D.微粒中的键角发生了改变
(4)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是___________________(请用相应的编号填写)

(5)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51 kJ/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能”是_________kJ/mol;
(6)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子。请写出生成此配合离子的离子方程式:____________________________________________。
【答案】 1s22s22p4 H2S或NH2- A BC 20 Cu2++4H2O=[Cu(H2O)4]2+
【解析】分析:(1)根据核外电子排布规律书写;
(2)原子数和价电子数分别都相等的微粒为等电子体;
(3)根据水分析以及水合氢离子中含有的化学键类型、空间构型判断;
(4)根据冰是分子晶体判断;
(5)根据升华热=范德华力+氢键判断;
(6)根据铜离子能与水分子形成配位键分析。
详解:(1)氧原子的核电荷数是8,根据构造原理可知外围电子有6个电子,2s能级上有2个电子,2p能级上有4个电子,所以水分子中氧原子在基态时核外电子排布式为1s22s22p4。
(2)水分子含有3个原子、8个价电子,因此与水互为等电子体的微粒有H2S、NH2-。
(3)A、水分子中氧原子含有2个共价单键和2个孤电子对,其空间构型是V型,所以水中氧的杂化为sp3,H3O+中氧的杂化为sp3,则氧原子的杂化类型没有改变,A错误;
B、水分子为V型,H3O+为三角锥型,则微粒的形状发生了改变,B正确;
C、因结构不同,则性质不同,微粒的化学性质发生了改变,C正确;
D、水分子为V型,键角是104.5°,H3O+为三角锥型,微粒中的键角发生了改变,D正确,答案选A;
(4)冰属于分子晶体,根据微粒的晶胞结构特点可知,A是离子晶体氯化钠的晶胞,构成微粒是离子。B为干冰的晶胞图,构成微粒为分子,属于分子晶体。C为碘的晶胞图,构成微粒为碘分子,所以分子晶体;D是原子晶体金刚石的晶胞,构成微粒是原子。E是金属晶体钠的晶胞,构成微粒是金属阳离子和自由电子,则与冰的晶体类型相同的是干冰和碘单质,答案选BC。
(5)在冰晶体中,每个水分子与相邻的4个水分子形成氢键,则根据结构图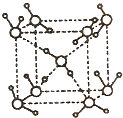 可知,1mol水中含有2mol氢键,升华热=范德华力+氢键。由于冰的升华热是51kJ/mol,水分子间的范德华力是11kJ/mol,所以冰晶体中氢键的“键能”是(51kJ/mol-11kJ/mol)÷2=20kJ/mol。
可知,1mol水中含有2mol氢键,升华热=范德华力+氢键。由于冰的升华热是51kJ/mol,水分子间的范德华力是11kJ/mol,所以冰晶体中氢键的“键能”是(51kJ/mol-11kJ/mol)÷2=20kJ/mol。
(6)无水硫酸铜溶于水后生成水合铜离子,铜离子提供空轨道,水分子中的氧原子提供孤电子对,形成配位键,则生成此配合离子的离子方程式Cu2++4H2O=[Cu(H2O)4]2+。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】A、B、C为中学常见单质,其中一种为金属;通常情况下A为固体、B为黄绿色气体、C为无色气体。D、E、F、G、H、X均为化合物,其中X常温下是无色气体,其水溶液是一种无氧强酸溶液,E为黑色固体,H在常温下为液体。它们之间的转化关系如图所示(其中某些反应条件和部分反应产物已略去)。
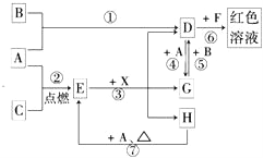
(1)写出下列物质的化学式:D___________,X_______________。
(2)在反应①~⑦中,不属于氧化还原反应的是_____________(填编号)。
(3)反应⑥的离子方程式为:______________________________________。
(4)往G溶液中加入NaOH溶液观察到的现象是________________________。
(5)反应⑦的化学方程式为____________________________________;该反应中每消耗0.3mol的A,可转移电子________mol。
(6)除去D溶液中混有的少量G的化学方程式:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.1mol/L的K2CO3溶液中逐滴加入0.1mol/L的稀盐酸40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)的物质的量分数随溶液pH变化的情况如下图所示。下列说法正确的是
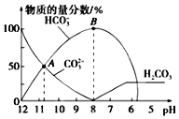
A. 随着稀盐酸的加入,溶液中c(HCO3-)·c(OH-)/c(CO32-)保持不变
B. 根据A点计算,Ka2(H2CO3)的数量级为10-3
C. B点所处的溶液中:c(K+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
D. 当pH约为8时,溶液中开始放出CO2气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将钠放入盛有空气的密闭容器中,生成Na2O还是Na2O2是由下列哪项因素所决定的( )
A.反应温度B.空气的量C.钠粒的大小D.钠的状态(s、l)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合溶液,经测定ClO-与ClO3-的物质的量浓度之比为1∶3,则此反应中氧化剂与还原剂的物质的量之比是( )
A.21∶5B.11∶3C.4∶1D.1∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水资源的利用具有非常广阔的前景,从海水中可提取多种化工原料。
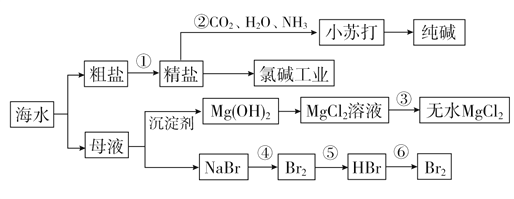
(1)海水淡化处理的方法有__________________________(写出两种即可)。
(2)粗盐中含有Ca2+、Mg2+、SO![]() 等杂质,精制时所用试剂为:
等杂质,精制时所用试剂为:
A.盐酸 B.BaCl2溶液 C.NaOH溶液 D.Na2CO3溶液
加入试剂的顺序是__________________。
(3)步骤②中,向精盐溶液中应先通入________,再通入________。
(4)氯碱工业中,与电源负极相连的电极附近溶液pH值________(填“变大”“变小”或“不变”)。用玻璃棒蘸浓氨水检验阳极产生的气体,发现产生大量白烟,白烟的主要成分是________________________。
(5)实际生产中,常选用________作为沉淀剂,从氯化镁溶液中得到无水晶体的操作为_____________________________________。
(6)步骤⑤用SO2水溶液吸收溴单质,吸收率可达93%,反应的离子方程式为______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C都是常见有机物,其转化关系如下(部分反应物、产物和反应条件已略去):
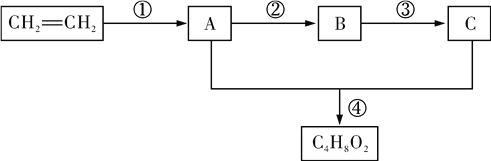
请回答下列问题:
(1)写出①的反应类型______________;
(2)写出C中官能团的名称____________;
(3)写出反应②的化学方程式________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁、戊是中学常见的无机物,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去)。下列说法不正确的是:
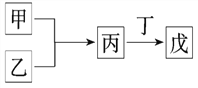
A. 若甲既能与盐酸反应又能与NaOH溶液反应,则丙可能属于两性氧化物
B. 若丙、丁混合产生白烟,且丙为18电子分子,丁为10电子分子,则乙的水溶液可能具有漂白作用
C. 若甲为短周期中原子半径最大的主族元素的单质,且戊为碱,则丙只能为Na2O2
D. 若甲、丙、戊含有同一种元素,则三种物质中,该元素的化合价由低到高的顺序可能为甲<丙<戊
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com