
【题目】A、B、C为中学常见单质,其中一种为金属;通常情况下A为固体、B为黄绿色气体、C为无色气体。D、E、F、G、H、X均为化合物,其中X常温下是无色气体,其水溶液是一种无氧强酸溶液,E为黑色固体,H在常温下为液体。它们之间的转化关系如图所示(其中某些反应条件和部分反应产物已略去)。
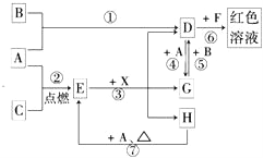
(1)写出下列物质的化学式:D___________,X_______________。
(2)在反应①~⑦中,不属于氧化还原反应的是_____________(填编号)。
(3)反应⑥的离子方程式为:______________________________________。
(4)往G溶液中加入NaOH溶液观察到的现象是________________________。
(5)反应⑦的化学方程式为____________________________________;该反应中每消耗0.3mol的A,可转移电子________mol。
(6)除去D溶液中混有的少量G的化学方程式:_________________。
【答案】FeCl3 HCl ③⑥ Fe3++3SCN-=Fe(SCN)3 生成白色沉淀,迅速变为灰绿色,最终变为红褐色 3Fe+4H2O(g)![]() Fe3O4+4H2 0.8 2Fe2++Cl2=2Fe3++2Cl-
Fe3O4+4H2 0.8 2Fe2++Cl2=2Fe3++2Cl-
【解析】
单质A和C反应生成E为黑色晶体,E黑色固体和X酸反应生成D、G、H,其中DG之间可以实现相互转化,说明A为变价金属Fe,和C在点燃条件下生成黑色固体E为Fe3O4,C为O2,依据D+A=G说明D为含三价铁离子的化合物,F为含SCN-离子的化合物,G为含Fe2+离子的化合物,H为H2O;依据G+B=D分析判断B是强氧化剂,B为黄绿色气体,证明为Cl2,所以推断D为FeCl3,得到G为FeCl2,X为HCl;依据判断出的物质回答问题。
根据以上分析可知A为金属Fe,B为Cl2,C为O2,D为FeCl3,E为Fe3O4,F为含SCN-离子的化合物,G为FeCl2,H为H2O,X为HCl;则
(1)依据分析推断可知,D为FeCl3,X为HCl;
(2)依据反应过程分析,①为铁和氯气发生的氧化还原反应,②为铁和氧气发生的氧化还原反应,③为四氧化三铁和盐酸发生的反应,不是氧化还原反应,④为氯化铁和铁发生的氧化还原反应,⑤为氯化亚铁和氯气发生的氧化还原反应,⑥是氯化铁和SCN-发生的反应,不是氧化还原反应,⑦为铁和水蒸气发生的氧化还原反应生成四氧化三铁和氢气,则在反应①~⑦中,不属于氧化还原反应的是③⑥;
(3)反应⑥是氯化铁和SCN-发生的反应,反应的离子方程式为Fe3++3SCN-=Fe(SCN)3;
(4)往G为FeCl2溶液中加入NaOH溶液观察到的现象是,生成白色氢氧化亚铁沉淀,被空气中氧气氧化为氢氧化铁,现象为生成白色沉淀,迅速变为灰绿色,最终变为红褐色;
(5)反应⑦是铁在水蒸气中发生的反应生成四氧化三铁和氢气,反应的化学方程式为3Fe+4H2O(g)![]() Fe3O4+4H2;该反应中氢元素化合价从+1价变化为0价,4mol水反应转移电子为8mol,消耗3mol铁,则每消耗0.3mol的Fe,可转移电子0.8mol。
Fe3O4+4H2;该反应中氢元素化合价从+1价变化为0价,4mol水反应转移电子为8mol,消耗3mol铁,则每消耗0.3mol的Fe,可转移电子0.8mol。
(6)氯化亚铁易被氯气氧化为氯化铁,则除去FeCl3溶液中混有的少量FeCl2的方法是向混合溶液中通入足量的氯气,反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-。


 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:
【题目】榴石矿石可以看作CaO、FeO、Fe2O3、Al2O3、SiO2组成。工业上对其进行综合利用的流程如下:
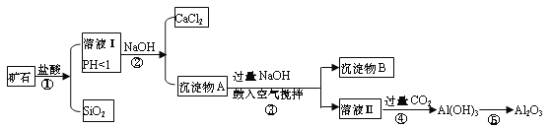
(1)用方程式表示盛放氢氧化钠溶液的试剂瓶不能用玻璃塞的原因________;
(2)溶液Ⅰ中除了Ca2+外,还可能含有的金属阳离子有_______________;
(3)步骤③中NaOH参加反应的离子方程式是________________,鼓入空气并充分搅拌的目的是_____________________。
(4)在工业生产中,步骤④通入过量CO2而不加入盐酸的原因是___________;写出步骤④通入过量CO2的离子方程式 _________________________________。
(5)试设计实验证明榴石矿中含有FeO(试剂任选,说明实验操作与现象)_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:一个碳原子上连多个羟基时不稳定:
芳香烃A有如图的转化关系:
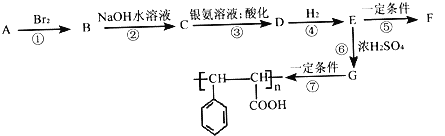
(1)已知1molA能与2molBr2加成,写出A的结构简式___________________;写出B的分子式___________________。
(2)D中含氧官能团的名称为______________,指出反应⑥的反应类型:___________________。
(3)写出C与银氨溶液反应的化学方程式:_________________________________。
(4)E有多种同分异构体,符号下列条件的共有__________种。
①属于芳香化合物; ②能使FeCl3溶液发生显色反应;
③含有酯的结构; ④苯环上有两个取代基。
其中核磁共振氢谱中有6组吸收峰,其面积之比为1∶2∶2∶2∶2∶1的有机物结构简式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个密闭的容器内有四种物质,高温下发生反应,一段时间后测得反应前后各物质的质量如下:
a | b | c | d | |
反应前质量(g) | 8 | 10 | 1 | 25 |
反应后质量(g) | 未测 | 24 | 2 | 16 |
若a的相对分子质量为2n,d的相对分子质量为3n,则该反应的化学方程式中a与d的化学计量数比为 ( )
A. 2∶3 B. 1∶2 C. 1∶3 D. 1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
四 | ⑨ | ⑩ |
(1)在这些元素中,最易失电子的元素是________,非金属性最强的元素是______;
(2)化学性质最不活泼的元素是_____,其原子的原子结构示意图为________;
(3)元素的最高价氧化物对应的水化物中酸性最强的是____,碱性最强的是___,呈两性的氢氧化物是_______________;(填写化学式)
(4)在③~⑦元素中,简单离子半径最小的是_________;
(5在⑦与⑩的单质中,氧化性较强的是_______________,用反应化学方程式证明:_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作能够达到实验目的的是
|
|
|
|
A.验证一定生成SO2 | B. 用排空气法收集NO | C. 制取并检验氨气 | D.用水吸收氨气 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷在加热条件下可还原氧化铜,气体产物除水蒸气外,还有碳的氧化物。某化学小组利用如图装置探究其反应产物。

[查阅资料]
①CO能与银氨溶液反应:CO+2[Ag(NH3)2]++2OH-===2Ag↓+2NH4++CO32-+2NH3
②Cu2O为红色,不与Ag+反应,能发生反应:Cu2O+2H+=Cu2++Cu+H2O
(1)装置A中反应的化学方程式为________________________________________。
(2)按气流方向各装置从左到右的连接顺序为A→____________。(填字母编号,装置不重复使用)
(3)实验中滴加稀盐酸的操作为____________________________________。
(4)已知气体产物中含有CO,则装置C中可观察到的现象是____________________;装置F的作用为_____________________。
(5)当反应结束后,装置D处试管中固体全部变为红色。
①设计实验证明红色固体中含有Cu2O:___________________________________________。
②为了证明红色固体中是否含有Cu,甲同学设计如下实验:向少量红色固体中加入适量0.1mol/L AgNO3溶液,发现溶液变蓝,据此判断红色固体中含有Cu。乙同学认为该方案不合理,欲证明甲同学的结论,还需增加如下对比实验,完成表中内容。
实验步骤(不要求写出具体操作过程) | 预期现象和结论 |
______________ | 若观察到溶液不变蓝,则证明红色固体中含有Cu;若观察到溶液变蓝,则不能证明红色固体中含有Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1 mol·L-1的三种酸(HA、HB和HD)溶液,滴定曲线如图所示,下列判断错误的是 ( )
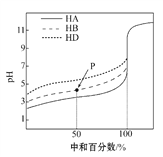
A. 三种酸的电离常数关系:KHA>KHB>KHD
B. pH=7时,三种溶液中:c(A-)=c(B-)=c(D-)
C. 滴定至P点时,溶液中:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)
D. 当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)= c(OH-)-c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水是生命之源,它与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。
(1)水分子中氧原子在基态时核外电子排布式为________________________;
(2)写出与H2O分子互为等电子体的微粒___________________(填1种即可)。
(3)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是___________________
A.氧原子的杂化类型发生了改变 B.微粒的形状发生了改变
C.微粒的化学性质发生了改变 D.微粒中的键角发生了改变
(4)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是___________________(请用相应的编号填写)

(5)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51 kJ/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能”是_________kJ/mol;
(6)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子。请写出生成此配合离子的离子方程式:____________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com