
【题目】将钠放入盛有空气的密闭容器中,生成Na2O还是Na2O2是由下列哪项因素所决定的( )
A.反应温度B.空气的量C.钠粒的大小D.钠的状态(s、l)
科目:高中化学 来源: 题型:
【题目】在一个密闭的容器内有四种物质,高温下发生反应,一段时间后测得反应前后各物质的质量如下:
a | b | c | d | |
反应前质量(g) | 8 | 10 | 1 | 25 |
反应后质量(g) | 未测 | 24 | 2 | 16 |
若a的相对分子质量为2n,d的相对分子质量为3n,则该反应的化学方程式中a与d的化学计量数比为 ( )
A. 2∶3 B. 1∶2 C. 1∶3 D. 1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1 mol·L-1的三种酸(HA、HB和HD)溶液,滴定曲线如图所示,下列判断错误的是 ( )
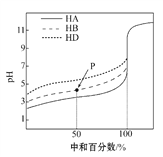
A. 三种酸的电离常数关系:KHA>KHB>KHD
B. pH=7时,三种溶液中:c(A-)=c(B-)=c(D-)
C. 滴定至P点时,溶液中:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)
D. 当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)= c(OH-)-c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在做氨的催化氧化实验时,铂丝不能接触氨水,原因是( )
A.铂丝温度高,接触氨水会使氨气大量逸出
B.防止铂丝温度降低而不能起催化作用
C.红热铂丝会与氨水反应,使铂丝腐蚀
D.防止爆炸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在研究Fe与H2SO4的反应时,进行了如下实验。
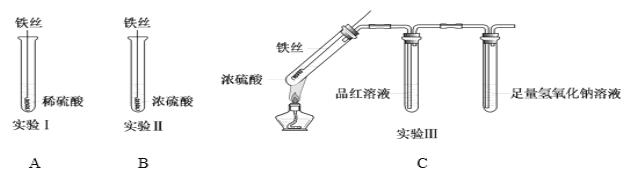
(1)实验Ⅰ中,铁与稀硫酸反应的离子方程式为__________________________________。
(2)实验Ⅱ中,铁丝表面迅速变黑,反应很快停止,其原因是________________________________。
(3)实验Ⅲ中,加热后产生大量气体,中间试管中品红溶液的红色褪去,最终未检测到可燃性气体。最后装NaOH溶液试管中反应的离子方程式是_________________________________。
(4)对比实验Ⅰ、Ⅱ和Ⅲ,同学们得出以下结论:
①浓硫酸和稀硫酸都具有氧化性,但原因不同。浓硫酸的氧化性源于+6价的硫元素,稀硫酸的氧化性源于______。
②造成反应多样性的主要因素有________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在下列晶体中:①NaOH、②Na2S、③(NH4)2S、④Na2O2、⑤C2H2、⑥SiC。其中既含有离子键又含有非极性共价键的离子晶体是__________;其中既含有离子键,又含有极性共价键和配位键的离子晶体是___________;其中含有极性共价键和非极性共价键的非极性分子是____________;其中属于原子晶体的是____________;
(2)Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物。
① 与Fe原子或离子形成配合物的分子或离子都具备的结构特点是_______________;
② 六氰合亚铁离子【Fe(CN)6】4-中的配体CN-中C原子的杂化轨道类型是________,写出一种与CN互为等电子体的单质分子的结构式_______;
(3)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华。易溶于水,也易溶于乙醚.丙酮等有机溶剂。据此判断三氯化铁晶体类型为_________________;
(4)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如下图所示。体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为_______________________。
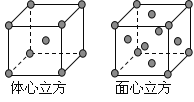
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水是生命之源,它与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。
(1)水分子中氧原子在基态时核外电子排布式为________________________;
(2)写出与H2O分子互为等电子体的微粒___________________(填1种即可)。
(3)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是___________________
A.氧原子的杂化类型发生了改变 B.微粒的形状发生了改变
C.微粒的化学性质发生了改变 D.微粒中的键角发生了改变
(4)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是___________________(请用相应的编号填写)

(5)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51 kJ/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能”是_________kJ/mol;
(6)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子。请写出生成此配合离子的离子方程式:____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学研究性学习小组的同学在学习了氨的性质后讨论:运用类比的思想,既然氨气具有还原性,能否像H2那样还原CuO呢?他们设计实验制取氨气并探究上述问题。请你参与该小组的活动并完成下列研究:
(一)制取氨气
(1)写出实验制取氨气的化学方程式______________________________________;
(2)在实验室中,还可以用浓氨水与____________(填写一种试剂)快速制取少量氨气;
(二)该小组中某同学设计了下图所示的实验装置(夹持及尾气处理装置未画出),探究氨气的还原性:
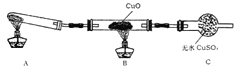
(1)该装置在设计上有一定缺陷,为保证实验结果的准确性,对该装置的改进措施是____。
(2)利用改进后的装置进行实验,观察到CuO变为红色物质,无水CuSO4变蓝色,同时生成一种无污染的气体。写出氨气与CuO反应的化学方程式:_________________________
(三)问题讨论
(1)有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O。已知:Cu2O是一种碱性氧化物;在酸性溶液中,Cu+的稳定性比Cu2+差(Cu+ ![]() Cu+Cu2+)。请你设计一个简单的实验检验该红色物质中是否含有Cu2O_______________________________________________。
Cu+Cu2+)。请你设计一个简单的实验检验该红色物质中是否含有Cu2O_______________________________________________。
(2)在解决了问题(1)后,又有同学提出:Cu2O与CuO的热稳定性哪个更强?于是他们进行了如下实验:取98 gCu(OH)2固体,加热至80℃~100℃时,得到黑色固体粉末,继续加热到1000℃以上,黑色粉末全部变为红色粉末A。冷却后称量,A的质量为72g。据此可推得,A的化学式为____________。由此,得到的结论是:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式是( )
A. 大理石溶于醋酸中:CaCO3+2H+═Ca2++CO2↑+H2O
B. 向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+═2Fe(OH)3+3Mg2+
C. MnO2与浓盐酸反应制Cl2:MnO2+4H++4Cl﹣![]() Mn2++2Cl2↑+2H2O
Mn2++2Cl2↑+2H2O
D. 浓硝酸中加入过量铁粉并加热:Fe+3NO3﹣+6H+![]() Fe3++3NO2↑+3H2O
Fe3++3NO2↑+3H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com