
【题目】某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合溶液,经测定ClO-与ClO3-的物质的量浓度之比为1∶3,则此反应中氧化剂与还原剂的物质的量之比是( )
A.21∶5B.11∶3C.4∶1D.1∶4
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
四 | ⑨ | ⑩ |
(1)在这些元素中,最易失电子的元素是________,非金属性最强的元素是______;
(2)化学性质最不活泼的元素是_____,其原子的原子结构示意图为________;
(3)元素的最高价氧化物对应的水化物中酸性最强的是____,碱性最强的是___,呈两性的氢氧化物是_______________;(填写化学式)
(4)在③~⑦元素中,简单离子半径最小的是_________;
(5在⑦与⑩的单质中,氧化性较强的是_______________,用反应化学方程式证明:_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在研究Fe与H2SO4的反应时,进行了如下实验。
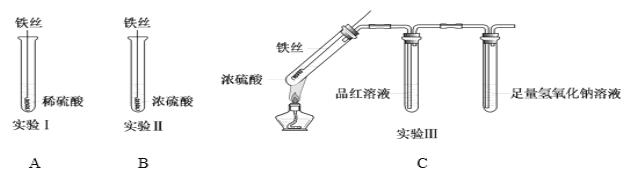
(1)实验Ⅰ中,铁与稀硫酸反应的离子方程式为__________________________________。
(2)实验Ⅱ中,铁丝表面迅速变黑,反应很快停止,其原因是________________________________。
(3)实验Ⅲ中,加热后产生大量气体,中间试管中品红溶液的红色褪去,最终未检测到可燃性气体。最后装NaOH溶液试管中反应的离子方程式是_________________________________。
(4)对比实验Ⅰ、Ⅱ和Ⅲ,同学们得出以下结论:
①浓硫酸和稀硫酸都具有氧化性,但原因不同。浓硫酸的氧化性源于+6价的硫元素,稀硫酸的氧化性源于______。
②造成反应多样性的主要因素有________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物H是一种工业染料,I是一种香料,由A为原料合成H和I的一种路线如下:
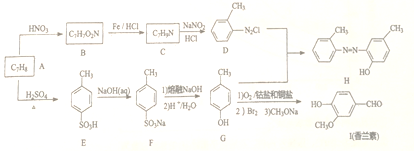
回答下列问题:
(1)A的名称为_______________。I中含氧官能团名称为______________。
(2)A生成E的反应类型为____________,B生成C的反应类型为_____________。
(3)B的结构简式为_________________。
(4)C生成D的化学方程式为_____________。
(5)二取代芳香化合物W是I的同分异构体。W能发生水解反应,且核磁共振氢谱有五组峰且面积比为1:2:2:2:1的结构简式为______________。
(6)参照上述合成路线,以间二甲苯和苯酚为原料(无机试剂任选),设计制备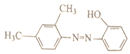 的合成路线___________。
的合成路线___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水是生命之源,它与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。
(1)水分子中氧原子在基态时核外电子排布式为________________________;
(2)写出与H2O分子互为等电子体的微粒___________________(填1种即可)。
(3)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是___________________
A.氧原子的杂化类型发生了改变 B.微粒的形状发生了改变
C.微粒的化学性质发生了改变 D.微粒中的键角发生了改变
(4)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是___________________(请用相应的编号填写)

(5)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51 kJ/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能”是_________kJ/mol;
(6)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子。请写出生成此配合离子的离子方程式:____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯度晶硅是典型的无机非金属材料,又称“半导体”材料,它的发现和使用曾引起计算机的一场 “革命”。它可以按下列方法制备:
![]()
下列说法正确的是
A. 步骤①的化学方程式为:SiO2+C![]() Si+CO2↑
Si+CO2↑
B. 步骤①②③中每生成或反应1mol Si,转移2mol电子
C. SiHCl3(沸点33.0℃)中含有少量的SiCl4(沸点67.6℃),通过蒸馏(或分馏)可提纯SiHCl3
D. 二氧化硅能与氢氟酸反应,而硅不能与氢氟酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子一定能大量共存的是( )
A. 加入铝粉有氢气产生的溶液中:Na+、K+、SO42-、Cl-、HCO3-
B. 含有大量硝酸根离子的溶液中:H+、Fe2+、SO42-、Cl-
C. 常温下,![]() =1×10-10的溶液中:NH4+、K+、Ca2+、Cl-
=1×10-10的溶液中:NH4+、K+、Ca2+、Cl-
D. 常温下pH=1的溶液中:MnO4-、NO3-、SO42-、Na+、Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象和结论均正确的是
选项 | 操 作 | 可能的现象 | 结 论 |
A | 向某溶液中先滴加少量氯水,再滴加KSCN溶液 | 溶液变为红色 | 溶液中一定含有Fe2+ |
B | 向酚酞溶液中加入过量的Na2O2 | 溶液先变红后褪色 | Na2O2与水生成的碱有漂白性 |
C | 将表面氧化的铜丝从酒精灯的外焰慢慢移向内焰 | 黑色的铜丝变红 | CuO被内焰中的乙醇蒸气还原 |
D | 向饱和 Na2CO3溶液中通入CO2 | 有晶体析出 | 溶解度:NaHCO3﹥Na2CO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com