
【题目】有机物G(分子式为C13H18O2)是一种香料,如图是该香料的一种合成路线。

已知:
①E能发生银镜反应,在一定条件下,1 mol E能与2 mol H2反应生成F;
②R—CH===CH2![]() R—CH2CH2OH;
R—CH2CH2OH;
③有机物D的摩尔质量为88 g·mol-1,其核磁共振氢谱有3组峰;
④有机物F是苯甲醇的同系物,苯环上只有一个无支链的侧链。
回答下列问题:
(1)用系统命名法命名有机物B________________;
(2)E的结构简式为__________________________;
(3)C与新制Cu(OH)2反应的化学方程式为____________________________;
(4)已知有机物甲符合下列条件:①为芳香族化合物;②与F互为同分异构体;③能被催化氧化成醛。符合上述条件的有机物甲有________种,写出一种满足苯环上有3个侧链,且核磁共振氢谱有5组峰,峰面积比为6∶2∶2∶1∶1的有机物的结构简式____________________;
(5)以丙烯等为原料合成D的路线如下:

X的结构简式为_______,步骤Ⅱ的反应条件为___________,步骤Ⅳ的反应类型为______。
【答案】 2-甲基-1-丙醇 C6H5CH=CHCHO (CH3)2CHCHO+2Cu(OH)2+NaOH![]() (CH3)2CHCOONa+Cu2O↓+3H2O 13种
(CH3)2CHCOONa+Cu2O↓+3H2O 13种 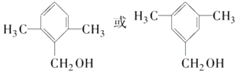 CH3CHBrCH3 NaOH的水溶液,加热 消去反应
CH3CHBrCH3 NaOH的水溶液,加热 消去反应
【解析】C氧化可生成D,则D应为酸,D的相对分子质量通过质谱法测得为88,它的核磁共振氢谱显示只有三组峰,其结构简式应为(CH3)2CHCOOH,则C为(CH3)2CHCHO;B为(CH3)2CHCH2OH,由题给信息可知A为(CH3)2C=CH2,有机物F是苯甲醇的同系物,苯环上只有一个无支链的侧链,结合G的分子式可知F为![]() ,E能够发生银镜反应,1molE与2molH2反应生成F,则E为
,E能够发生银镜反应,1molE与2molH2反应生成F,则E为![]() ,G为
,G为![]() ,则
,则
(1)B为(CH3)2CHCH2OH,按照醇的系统命名法命名;正确答案:2-甲基-1-丙醇;
(2)根据以上分析可知E的结构简式为![]() ;正确答案:
;正确答案:![]()
(3)(CH3)2CHCHO被新制Cu(OH)2氧化为羧酸;正确答案: (CH3)2CHCHO+2Cu(OH)2+NaOH![]() (CH3)2CHCOONa+Cu2O↓+3H2O;
(CH3)2CHCOONa+Cu2O↓+3H2O;
(4)
F为![]() ,符合:①为芳香族化合物;②与F是同分异构体;③能被催化氧化成醛的化合物有:若苯环上只有1个取代基,取代基为—CH(CH3)—CH2OH,只有1种;若苯环上有2个取代基,可能是甲基和—CH2CH2OH,邻间对3种,也可以是—CH2CH3和—CH2OH,邻间对3种;若苯环上有3个取代基,只能是两个—CH3和一个—CH2OH,采用定一议二原则判断,有6种,所以共有13种。其中满足苯环上有3个侧链,且核磁共振氢谱有5组峰,峰面积比为6∶2∶2∶1∶1的有机物的结构简式为
,符合:①为芳香族化合物;②与F是同分异构体;③能被催化氧化成醛的化合物有:若苯环上只有1个取代基,取代基为—CH(CH3)—CH2OH,只有1种;若苯环上有2个取代基,可能是甲基和—CH2CH2OH,邻间对3种,也可以是—CH2CH3和—CH2OH,邻间对3种;若苯环上有3个取代基,只能是两个—CH3和一个—CH2OH,采用定一议二原则判断,有6种,所以共有13种。其中满足苯环上有3个侧链,且核磁共振氢谱有5组峰,峰面积比为6∶2∶2∶1∶1的有机物的结构简式为
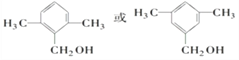
正确答案:13种; 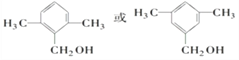
(5)D结构简式为(CH3)2CHCOOH,以丙烯等为原料合成D的路线可知,反应Ⅰ为加成反应,X为CH3CHBrCH3,其在NaOH的水溶液中加热生成CH3CHOHCH3,反应Ⅳ、Ⅴ分别为消去反应和加成反应。正确答案:CH3CHBrCH3 ; NaOH的水溶液,加热; 消去反应;


科目:高中化学 来源: 题型:
【题目】下列各组物质中,所含原子数相同的是:( )
A. 8gH2和8gO2 B. 5.6LN2(标况)和11gCO2
C. 2.24LH2(标况)和0.1molN2 D. 9gH2O和0.5molBr2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Fe(OH)3胶体微粒能吸附Fe3+离子。在约50mL的沸水中,滴入8—10滴(20滴约为1mL)饱和FeCl3溶液至其为红褐色后,将它们装入半透膜袋中,并浸没在盛有蒸馏水的烧杯中。隔一段时间后,烧杯里的水中含有的离子最多的是 ( )
A. H+、OH- B. H+、Cl- C. Fe3+、Cl- D. Fe3+、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇燃料电池体积小巧、洁净环保、理论能量比高,已在便携式通讯设备、汽车等领域应用。某型甲醇燃料电池的总反应式2CH40+302=2C02↑+4H20,下图是该燃料电池的示意图。
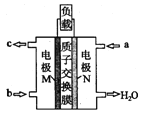
下列说法错误的是
A.燃料电池将化学能转化为电能
B.a是甲醇,b是氧气
C.质子从M电极区穿过交换膜移向N电极区
D.负极反应:CH40-6e-+H20=C02↑+6H+
查看答案和解析>>
科目:高中化学 来源: 题型:
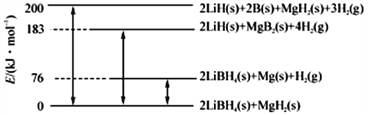
【题目】Ⅰ.开发新能源,新材料是实现社会可持续发展的需要。下图是LiBH4/MgH2体系放氢的焓变示意图,则Mg(s)+2B(s)==MgB2(s)的ΔH=_________kJ·mol-1。
Ⅱ.在1.0L恒容密闭容器中放入0.10mol A(g),在一定温度时进行如下反应:A(g)==2B(g)+C(g)+D(S) ΔH=+85.1kJ·mol-1。
容器内气体总压强P与起始压强P0的比值随反应时间变化数据见下表:
时间t/min | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 |
P/P0 | 1.00 | 1.50 | 1.80 | 2.20 | 2.30 | 2.38 | 2.40 | 2.40 |
回答下列问题:
(1)下列能提高A的转化率的是______________。
A.升高温度 B.向体系中通入气体A
C. 减少D的物质的量 D.向体系中通入稀有气体
(2)下列说法能表明该反应达到化学平衡状态的是_______________。
A.A、B、C的物质的量之比为1∶2∶1 B.单位时间内生成2n mol B,同时生成n mol C
C.容器中气体的密度不变 D.容器中气体的平均摩尔质量不变
(3)达到平衡状态时A的转化率是________(结果保留两位有效数字)。
(4)相同条件下,若该反应从逆向开始,建立与上述相同的化学平衡,则D的取值范围为n(D)_______ mol。
(5)相同条件下,若将容器改为恒压容器,进行上述反应,某时刻,A的转化率为75%,则此时B的物质的量浓度为______________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 0.1 mol·L-1氨水中,c(OH-)=c(NH4+)
B. 10 mL 0.02 mol·L-1 HCl溶液与10 mL 0.02 mol·L-1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=12
C. 在0.1 mol·L-1的(NH4)2SO4溶液中,c(SO42-)>c(NH4+)>c(H+)>c(OH-)
D. 0.1 mol·L-1某二元弱酸强碱盐NaHA溶液中,c(Na+)=2c(A2-)+c(HA-)+c(H2A)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙两容器,甲容器容积固定,乙容器容积可变。一定温度下,在甲中加入2 mol N2、3 mol H2,反应N2(g)+3H2(g)![]() 2NH3(g)达到平衡时生成NH3的物质的量为m mol。
2NH3(g)达到平衡时生成NH3的物质的量为m mol。
(1)相同温度下,在乙中加入4 mol N2、6 mol H2,若乙的压强始终与甲的压强相等,乙中反应达到平衡时,生成NH3的物质的量为________mol(从下列各项中选择,只填序号,下同);若乙的容积与甲的容积始终相等,乙中反应达到平衡时,生成NH3的物质的量为________mol。
A.小于m B.等于m C.在m~2m之间 D.等于2m E.大于2m
(2)相同温度下,保持乙的容积为甲的一半,并加入1 mol NH3,要使乙中反应达到平衡时,各物质的体积分数与上述甲容器中达到平衡时相同,则起始应加入______mol N2和________mol H2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料电池能有效提高能源利用率,具有广泛的应用前景.下列物质均可用作燃料电池的燃料,其中最环保的是( )
A.一氧化碳
B.天然气
C.乙醇
D.氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016 年,《Nature》期刊报道一例CH3OH-O2在聚合物催化下的原电池,其工作示意图如下。下列说法正确的是
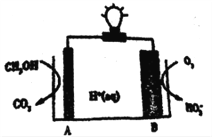
A. 电极B的电极反应为:O2+2e-+H+=HO2- B. 电解质溶液中H+由电极B流向A极
C. 电极A是负极,发生还原反应 D. 外电路中通过3mol电子,生成CO211.2 L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com