
【题目】短周期元素W、X、Y、Z、M的原子序数依次增大,元素W的一种核素的中子数为0,X的原子最外层电子数是次外层的2倍,Z与M同主族,Z2电子层结构与氖相同。
(1)M位于元素周期表中第______周期______族。
(2)化合物p由W、X、Y、M四种元素组成。已知向p溶液中加入FeCl3溶液,溶液变血红色;向p溶液中加入NaOH溶液并加热可放出使湿润的红色石蕊试纸变蓝的气体。p的化学式为_________。
(3)由X、Y、Z三种元素可组成摩尔质量为84g/mol的物质q,且q分子中三种元素的原子个数之比为1:1:1。已知q分子中各原子均达到8电子稳定结构,且分子中不含双键,但含极性键和非极性键,q分子的结构式为_______________。
(4) (XY)2的性质与Cl2相似,(XY)2与NaOH溶液反应的离子方程式为_________。
【答案】 三 VIA NH4SCN N≡COOC≡N (CN)2+2OH=CN+CNO+H2O
【解析】元素W的一种核素的中子数为0,应为H元素;X的原子最外层电子数是次外层的2倍,应为C元素,Z与M同主族,Z2-电子层结构与氖相同,则Z为O元素,M为S元素,因为短周期元素W、X、Y、Z、M的原子序数依次增大,因此Y为N元素。
(2)向p溶液中加入FeCl3溶液,溶液变血红色,说明含有SCN-离子,向p溶液中加入NaOH溶液并加热可放出使湿润的红色石蕊试纸变蓝的气体,说明含有铵根离子;
(3)X中三种元素的原子数目之比为1:1:1,设分子式为:(CON)x,则x=![]() =2,所以分子式为:(CON)2,各原子均达到8电子稳定结构,可确定结构式;
=2,所以分子式为:(CON)2,各原子均达到8电子稳定结构,可确定结构式;
(4)(CN)2的性质与Cl2相似,(CN)2与NaOH溶液反应生成CN-、CNO-、H2O,据此书写方程式。
根据上述分析,W为H元素,X为C元素,Y为N元素,Z为O元素,M为S元素。
(1)M为S元素,位于周期表第三周期族VIA,故答案为:三;VIA;
(2)向p溶液中加入FeCl3溶液,溶液变血红色,说明含有SCN-离子,向p溶液中加入NaOH溶液并加热可放出使湿润的红色石蕊试纸变蓝的气体,说明含有铵根离子,则应为NH4SCN,故答案为:NH4SCN;
(3)X中三种元素的原子数目之比为1:1:1,设分子式为:(CON)x,则x= ![]() =2,所以分子式为:(CON)2,各原子均达到8电子稳定结构,且分子中无双键,所以结构式为:N≡C-O-O-C≡N,故答案为:N≡C-O-O-C≡N;
=2,所以分子式为:(CON)2,各原子均达到8电子稳定结构,且分子中无双键,所以结构式为:N≡C-O-O-C≡N,故答案为:N≡C-O-O-C≡N;
(4)(CN)2的性质与Cl2相似,(CN)2与NaOH溶液反应的离子方程式为(CN)2+2OH-=CN-+CNO-+H2O,故答案为:(CN)2+2OH-=CN-+CNO-+H2O。


 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
【题目】下列各图为几种晶体或晶胞的构型示意图。
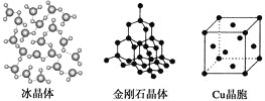

请回答下列问题:
(1)这些晶体中,粒子之间以共价键结合形成的晶体是_______________________。
(2)冰、金刚石、MgO、CaCl2、干冰5种晶体的熔点由高到低的顺序为_________。
(3)NaCl晶胞与MgO晶胞相同,NaCl晶体的晶格能________(填“大于”或“小于”)MgO晶体的晶格能,原因是___________________________________________。
(4)每个Cu晶胞中实际占有________个Cu原子,CaCl2晶体中Ca2+的配位数为________。
(5)冰的熔点远高于干冰的重要原因是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知苯乙烯的结构为![]() ,有关该物质的下列说法正确的是( )
,有关该物质的下列说法正确的是( )
A. 与液溴混合后加入铁粉可发生取代反应
B. 该物质能使溴水和酸性高锰酸钾溶液褪色,褪色原理完全相同
C. 苯乙烯分子的所有原子不可能在同一平面上
D. 除去乙苯中混有的苯乙烯可以通入等量氢气反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验事实:
(1)X+Y2+=X2++Y;(2)Z+2H2O![]() Z(OH)2+H2↑;(3)Z2+离子的放电能力比X2+弱;(4)由Y、W 作电极组成的原电池反应为:Y-2e-=Y2+,由此可知,X、Y、Z、W的还原性由强到弱的顺序是
Z(OH)2+H2↑;(3)Z2+离子的放电能力比X2+弱;(4)由Y、W 作电极组成的原电池反应为:Y-2e-=Y2+,由此可知,X、Y、Z、W的还原性由强到弱的顺序是
A. X > Y > Z > WB. Y > X > W > Z
C. Z > X > Y > WD. Z > Y > X > W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酯化反应是酸与醇反应生成酯和水的反应,如乙酸与乙醇在浓硫酸催化作用下生成乙酸乙酯和水的反应就是酯化反应。下列关于酯化反应的说法正确的是( )
A.属于中和反应
B.属于取代反应
C.酸分子中去氢原子
D.醇分子中去羟基
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. Ca(ClO)2溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O=CaSO4↓+H++Cl-+ HClO
B. 向FeCl2溶液加入足量NaClO溶液:6Fe2++3ClO-+3H2O=2Fe(OH)3↓+4Fe3++3Cl-
C. NH4HCO3溶液和过量的NaOH溶液混合:HCO![]() +OH-===CO
+OH-===CO![]() +H2O
+H2O
D. 向Fe(NO3)3溶液中加入足量的HI溶液:2Fe3++2I-= 2Fe2++I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列关于充电电池、干电池的叙述合理的是___________。
①干电池可以实现化学能向电能的转化和电能向化学能的转化
②锌锰干电池长时间连续使用时内装糊状物可能流出腐蚀电器
③充电电池可以无限制地反复放电、充电
④充电是使放电时的氧化还原反应逆向进行
(2)铅蓄电池中,正极材料为PbO2,负极材料为Pb,放电时其负极反应式为_____________。
(3)原电池在NaOH溶液介质中,铝为负极,其负极反应式为_______________。
(4)如图为绿色电源“二甲醚(CH3OCH3)燃料电池”的工作原理示意图。b电极是_____极,请写出负极的电极反应方程式:___________________________。
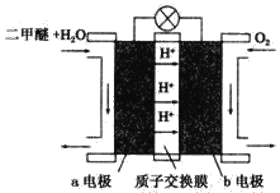
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中通入物质的量浓度均0.1mol·L-1的CH4与CO2,在一定条件下发生反应:CO2(g)+CH4(g)![]() 2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如图5,下列有关说法正确的是( )
2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如图5,下列有关说法正确的是( )

A. 上述反应的△H>0 B. 压强P1>P2>P3>P4
C. 1100℃该反应的平衡常数为64 D. 压强为P4时,在Y点:v(正)<v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作规范且能达到目的的是
目的 | 操作 | |
A. | 取20.00 mL盐酸 | 在50 mL酸式滴定管中装入盐酸,调整初始读数为30.00 mL后,将剩余盐酸放入锥形瓶 |
B. | 测定醋酸钠溶液pH | 用玻璃棒蘸取溶液,点在湿润的pH试纸上 |
C. | 清洗碘升华实验所用试管 | 先用酒精清洗,再用水清洗 |
D. | 配制浓度为0.010 | 称取KMnO4固体0.158 g,放入100 mL容量瓶中,加水溶解并稀释至刻度 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com