
【题目】下列各图为几种晶体或晶胞的构型示意图。
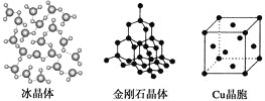

请回答下列问题:
(1)这些晶体中,粒子之间以共价键结合形成的晶体是_______________________。
(2)冰、金刚石、MgO、CaCl2、干冰5种晶体的熔点由高到低的顺序为_________。
(3)NaCl晶胞与MgO晶胞相同,NaCl晶体的晶格能________(填“大于”或“小于”)MgO晶体的晶格能,原因是___________________________________________。
(4)每个Cu晶胞中实际占有________个Cu原子,CaCl2晶体中Ca2+的配位数为________。
(5)冰的熔点远高于干冰的重要原因是___________________________________。
【答案】 金刚石晶体 金刚石>MgO>CaCl2>冰>干冰 小于 MgO晶体中离子的电荷数大于NaCl晶体中离子电荷数;且r(Mg2+)<r(Na+)、r(O2-)<r(Cl-) 4 8 H2O分子之间存在氢键
【解析】(1)原子晶体中原子间以共价键结合,则粒子之间以共价键结合形成的晶体是金刚石晶体;(2)熔点的一般规律:原子晶体>离子晶体>分子晶体,冰和干冰属于分子晶体,熔点:冰>干冰,MgO和CaCl2属于离子晶体,熔点:MgO>CaCl2,金刚石是原子晶体,则熔点由高到低的顺序为:金刚石>MgO>CaCl2>冰>干冰;(3)因为MgO中离子带两个电荷,NaCl中离子带一个电荷,氧离子半径小于氯离子,根据离子半径越小,离子带电荷越多,晶格能越大,可得NaCl晶体的晶格能小于MgO晶体的晶格能,故答案为:MgO晶体中离子的电荷数大于NaCl晶体中离子电荷数;且r(Mg2+)<r(Na+)、r(O2-)<r(Cl-);(4)Cu原子占据面心和顶点,则每个Cu晶胞中实际占有的原子数为8×![]() +6×
+6×![]() =4;根据氯化钙的晶胞图可知,每个Ca2+周围有8个Cl-,而每个Cl-周围有4个Ca2+,所以CaCl2晶体中Ca2+的配位数为8;(5)冰的熔点远高于干冰,除H2O是极性分子、CO2是非极性分子外,水分子间含有氢键,氢键的作用力大于范德华力,所以其熔沸点较高;故答案为:H2O分子之间能形成氢键。
=4;根据氯化钙的晶胞图可知,每个Ca2+周围有8个Cl-,而每个Cl-周围有4个Ca2+,所以CaCl2晶体中Ca2+的配位数为8;(5)冰的熔点远高于干冰,除H2O是极性分子、CO2是非极性分子外,水分子间含有氢键,氢键的作用力大于范德华力,所以其熔沸点较高;故答案为:H2O分子之间能形成氢键。


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是 ( )
A. 用醋酸除去水垢:2H++CaCO3===Ca2++CO2↑+H2O
B. 酸性氯化亚铁溶液中加入双氧水2Fe2++H2O2===2Fe3++O2↑+2H+
C. NaAlO2溶液中通入过量CO2:2AlO2—+CO2+3H2O=2Al(OH)3↓+CO32-
D. 电解饱和食盐水获取烧碱和氯气:2Cl-+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】300mL硫酸铝溶液中,含Al3+为1.62g,在该溶液中加入0.1mol/L氢氧化钡溶液300mL,反应后溶液中硫酸根离子的物质的量浓度为(忽略溶液混合体积的变化)
A. 0.4mol/L B. 0.3mol/L C. 0.2mol/L D. 0.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 纤维素三硝酸酯的结构简式为
B. 化合物![]() 是苯的同系物
是苯的同系物
C. 按系统命名法,化合物 的名称为2,3,3-三甲基丁烷
的名称为2,3,3-三甲基丁烷
D. 1 mol阿斯匹林(![]() )与足量的NaOH溶液反应,消耗NaOH最大的物质的量为2mol
)与足量的NaOH溶液反应,消耗NaOH最大的物质的量为2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有0.2mol某有机物和0.5mol氧气在一密闭容器中燃烧得产物为CO2、CO、H2O(气)。产物依次通过浓硫酸时,浓硫酸的质量增加了 10.8g;再通过灼热的氧化铜时,氧化铜的质量减轻了 3.2g;又通过碱石灰时,碱石灰的质量增加了 17.6g。该有机物的化学式是
A. C2H4 B. C2H6O C. C2H6O2 D. C3H6O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卡托普利(E)是用于治疗各种原发性高血压的药物,其合成路线如下:

(1)A的系统命名为____________,B中官能团的名称是________,B→C的反应类型是________。
(2)C→D转化的另一产物是HCl,则试剂X的分子式为________。
(3)D在NaOH醇溶液中发生消去反应,经酸化后的产物Y有多种同分异构体,写出同时满足下列条件的物质Y的同分异构体的结构简式:_______________、______________________________。
a.红外光谱显示分子中含有苯环,苯环上有四个取代基且不含甲基
b.核磁共振氢谱显示分子内有6种不同环境的氢原子
c.能与FeCl3溶液发生显色反应
(4)B在氢氧化钠溶液中的水解产物酸化后可以发生聚合反应,写出该反应的化学方程式:_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向10mL![]() NH4Al(SO4)2溶液中,滴加等浓度Ba(OH)2溶液x mL,下列叙述正确的是
NH4Al(SO4)2溶液中,滴加等浓度Ba(OH)2溶液x mL,下列叙述正确的是
A. x=10时,溶液中有NH4+、Al3+、SO42-,且c(NH4+)>c(Al3+)
B. x=10时,溶液中有NH4+、AlO2-、SO42-,且 c(NH4+)>c(SO42-)
C. x=30时,溶液中有Ba2+、AlO2-、OH-,且 c(OH-)<c AlO2-)
D. x=30时,溶液中有Ba2+、Al3+、OH-,且 c(OH-)=c(Ba2+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示(B中冷却装置未画出),将氯气和空气(不参与反应)以体积比约1∶3混合通入含水8%的碳酸钠中制备Cl2O,并用水吸收Cl2O制备次氯酸溶液。
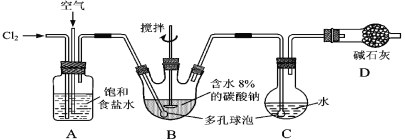
已知:Cl2O极易溶于水并与水反应生成HClO;Cl2O的沸点为3.8 ℃,42 ℃以上分解为Cl2和O2。
(1)①实验中控制氯气与空气体积比的方法是____________________________。
②为使反应充分进行,实验中采取的措施有______________________________。
③装置D的作用是______________________________。
(2)①装置B中产生Cl2O的化学方程式为:____________________________________。
②若B无冷却装置,则进入C中的Cl2O会大量减少。其原因是_____________________。
(3)装置C中采用棕色圆底烧瓶是因为______________________________________。
(4)已知次氯酸可被H2O2、FeCl2等物质还原成Cl-。测定C中次氯酸溶液的物质的量浓度的实验方案为:用______(填“酸”或“碱”)式滴定管取20.00 mL次氯酸溶液,加入足量的______,再加入足量的______,过滤,洗涤沉淀,在真空干燥箱中干燥,用电子天平称量沉淀质量。 (可选用的试剂:H2O2溶液、FeCl2溶液、AgNO3溶液)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z、M的原子序数依次增大,元素W的一种核素的中子数为0,X的原子最外层电子数是次外层的2倍,Z与M同主族,Z2电子层结构与氖相同。
(1)M位于元素周期表中第______周期______族。
(2)化合物p由W、X、Y、M四种元素组成。已知向p溶液中加入FeCl3溶液,溶液变血红色;向p溶液中加入NaOH溶液并加热可放出使湿润的红色石蕊试纸变蓝的气体。p的化学式为_________。
(3)由X、Y、Z三种元素可组成摩尔质量为84g/mol的物质q,且q分子中三种元素的原子个数之比为1:1:1。已知q分子中各原子均达到8电子稳定结构,且分子中不含双键,但含极性键和非极性键,q分子的结构式为_______________。
(4) (XY)2的性质与Cl2相似,(XY)2与NaOH溶液反应的离子方程式为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com