
【题目】如下图所示(B中冷却装置未画出),将氯气和空气(不参与反应)以体积比约1∶3混合通入含水8%的碳酸钠中制备Cl2O,并用水吸收Cl2O制备次氯酸溶液。
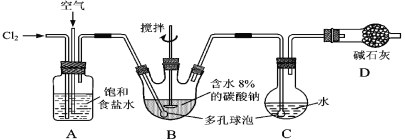
已知:Cl2O极易溶于水并与水反应生成HClO;Cl2O的沸点为3.8 ℃,42 ℃以上分解为Cl2和O2。
(1)①实验中控制氯气与空气体积比的方法是____________________________。
②为使反应充分进行,实验中采取的措施有______________________________。
③装置D的作用是______________________________。
(2)①装置B中产生Cl2O的化学方程式为:____________________________________。
②若B无冷却装置,则进入C中的Cl2O会大量减少。其原因是_____________________。
(3)装置C中采用棕色圆底烧瓶是因为______________________________________。
(4)已知次氯酸可被H2O2、FeCl2等物质还原成Cl-。测定C中次氯酸溶液的物质的量浓度的实验方案为:用______(填“酸”或“碱”)式滴定管取20.00 mL次氯酸溶液,加入足量的______,再加入足量的______,过滤,洗涤沉淀,在真空干燥箱中干燥,用电子天平称量沉淀质量。 (可选用的试剂:H2O2溶液、FeCl2溶液、AgNO3溶液)。
【答案】通过观察A中产生气泡的速率调节流速搅拌、使用多孔球泡吸收未反应的氯气,防止污染空气2Cl2+Na2CO3===Cl2O+2NaCl+CO2该反应放热,温度升高Cl2O会分解HClO见光易分解酸 H2O2溶液硝酸银溶液
【解析】
(1)①通过观察A中产生气泡的速率调节流速,进而控制氯气与空气的比例;②装置B安装有搅拌棒,所以搅拌或使用多孔球泡可以使反应更充分;③装置D的作用是吸收未反应的氯气,防止污染空气;
(2)①装置B中,氯气和碳酸钠反应生成Cl2O、氯化钠和二氧化碳,化学方程式为:2Cl2+Na2CO3═Cl2O+2NaCl+CO2;
②由于该反应为放热反应,温度升高Cl2O会分解,故进入C中的Cl2O会大量减少;
(3)水吸收Cl2O制备次氯酸溶液,HClO见光易分解,故装置C中采用棕色圆底烧瓶;
(4)次氯酸溶液既有酸性,又有强氧化性,应选用酸式滴定管;具体实验操作是:向20.00mL的次氯酸溶液里加入足量的H2O2溶液,再加入足量的AgNO3溶液,过滤、洗涤,在真空干燥箱中干燥沉淀,用电子天平称量沉淀的质量。


科目:高中化学 来源: 题型:
【题目】石墨烯具有原子级的厚度、优异的电学性能、出色的化学稳定性和热力学稳定性。制备石墨烯方法有石墨剥离法、化学气相沉积法等。石墨烯的球棍模型及分子结构示意图如下:

(1)下列有关石墨烯说法正确的是________。
A.石墨烯的结构与金刚石相似
B.石墨烯分子中所有原子可以处于同一平面
C.12 g石墨烯含σ键数为NA
D.从石墨剥离得石墨烯需克服石墨层与层之间的分子间作用力
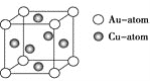
(2)化学气相沉积法是获得大量石墨烯的有效方法之一,催化剂为金、铜、钴等金属或合金,含碳源可以是甲烷、乙炔、苯、乙醇或酞菁等中的一种或任意组合。
①钴原子在基态时,核外电子排布式为________。
②乙醇沸点比氯乙烷高,主要原因是_______________________。
③下图是金与铜形成的金属互化物合金,它的化学式可表示为:________。
④含碳原子且属于非极性分子的是________;
a.甲烷 b.乙炔 c.苯 d.乙醇
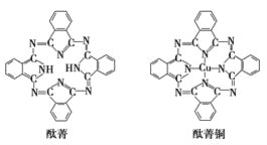
⑤酞菁与酞菁铜染料分子结构如下图,酞菁分子中氮原子采用的杂化方式有:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各图为几种晶体或晶胞的构型示意图。
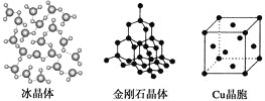

请回答下列问题:
(1)这些晶体中,粒子之间以共价键结合形成的晶体是_______________________。
(2)冰、金刚石、MgO、CaCl2、干冰5种晶体的熔点由高到低的顺序为_________。
(3)NaCl晶胞与MgO晶胞相同,NaCl晶体的晶格能________(填“大于”或“小于”)MgO晶体的晶格能,原因是___________________________________________。
(4)每个Cu晶胞中实际占有________个Cu原子,CaCl2晶体中Ca2+的配位数为________。
(5)冰的熔点远高于干冰的重要原因是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列装置属于原电池的是___________;
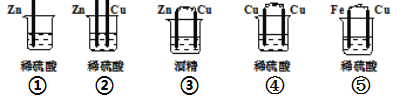
(2)在选出的原电池中,______ 是负极,发生______(氧化、还原) 反应 ,______ 是正极 ,该极的现象___________________________;
(3)在该原电池的内电路中,硫酸根离子移向_________(正、负)极。
(4)此原电池反应的化学方程式为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关细胞中水的叙述,错误的是
A. 细胞内参与物质运输的水是自由水
B. 越冬的动物体内结合水的比例相对较高
C. 同一个体的不同器官的含水量相同
D. 植物蒸腾作用中失去的水主要是自由水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着人们生活水平的不断提高和环境保护意识的不断增强,家庭绿化日益普及。对绿色观叶植物适当补充镁元素,可使其正常生长,其原因是( )
A. 镁是合成蛋白质的原料
B. 镁是合成核酸的原料
C. 镁能够促进植物对水分的吸收
D. 镁是组成叶绿素的重要元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知苯乙烯的结构为![]() ,有关该物质的下列说法正确的是( )
,有关该物质的下列说法正确的是( )
A. 与液溴混合后加入铁粉可发生取代反应
B. 该物质能使溴水和酸性高锰酸钾溶液褪色,褪色原理完全相同
C. 苯乙烯分子的所有原子不可能在同一平面上
D. 除去乙苯中混有的苯乙烯可以通入等量氢气反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验事实:
(1)X+Y2+=X2++Y;(2)Z+2H2O![]() Z(OH)2+H2↑;(3)Z2+离子的放电能力比X2+弱;(4)由Y、W 作电极组成的原电池反应为:Y-2e-=Y2+,由此可知,X、Y、Z、W的还原性由强到弱的顺序是
Z(OH)2+H2↑;(3)Z2+离子的放电能力比X2+弱;(4)由Y、W 作电极组成的原电池反应为:Y-2e-=Y2+,由此可知,X、Y、Z、W的还原性由强到弱的顺序是
A. X > Y > Z > WB. Y > X > W > Z
C. Z > X > Y > WD. Z > Y > X > W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中通入物质的量浓度均0.1mol·L-1的CH4与CO2,在一定条件下发生反应:CO2(g)+CH4(g)![]() 2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如图5,下列有关说法正确的是( )
2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如图5,下列有关说法正确的是( )

A. 上述反应的△H>0 B. 压强P1>P2>P3>P4
C. 1100℃该反应的平衡常数为64 D. 压强为P4时,在Y点:v(正)<v(逆)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com