
【题目】(1)下列装置属于原电池的是___________;
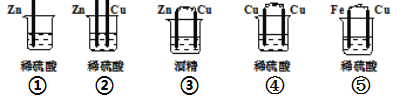
(2)在选出的原电池中,______ 是负极,发生______(氧化、还原) 反应 ,______ 是正极 ,该极的现象___________________________;
(3)在该原电池的内电路中,硫酸根离子移向_________(正、负)极。
(4)此原电池反应的化学方程式为___________________________。
【答案】⑤ Fe 氧化 Cu 有气泡产生 负 Fe+H2SO4= FeSO4+ H2↑
【解析】
(1)①中没有两个活泼性不同的电极,所以不能构成原电池,故①错误;
②没有构成闭合回路,所以不能构成原电池,故②错误;
③酒精为非电解质溶液,所以不能构成原电池,故错③误;
④电极材料相同,所以不能构成原电池,故④错误;
⑤符合原电池的构成条件,所以能构成原电池,故⑤正确。
故答案为:⑤。
(2)该装置中,铁易失电子而作负极,铜作正极,负极上铁失电子生成亚铁离子发生氧化反应,正极上氢离子得电子发生还原反应而生成氢气,所以有气泡生成,故答案为:氧化,Cu,有气泡产生。
(3)原电池内电路中,硫酸根是阴离子,阴离子移向负极,故答案为:负。
(4)该原电池中,铁失电子生成亚铁离子,正极上氢离子得电子生成氢气,所以电池反应式为:Fe+H2SO4=FeSO4+H2↑,故答案为:Fe+H2SO4=FeSO4+H2↑。


科目:高中化学 来源: 题型:
【题目】有下列物质:①O2 ②CO2 ③NH3 ④Na2O ⑤Na2O2 ⑥NaOH ⑦MgCl2 ⑧H2O2 ⑨NH4Cl ⑩N2,回答下列问题:
(1)只含有极性键的是__;只含有非极性键的是__;只含有离子键的离子化合物是___;含有非极性键的离子化合物是____。(均填序号)
(2)写出⑤、⑨的电子式_____、______
(3)用电子式表示MgCl2的形成过程:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 纤维素三硝酸酯的结构简式为
B. 化合物![]() 是苯的同系物
是苯的同系物
C. 按系统命名法,化合物 的名称为2,3,3-三甲基丁烷
的名称为2,3,3-三甲基丁烷
D. 1 mol阿斯匹林(![]() )与足量的NaOH溶液反应,消耗NaOH最大的物质的量为2mol
)与足量的NaOH溶液反应,消耗NaOH最大的物质的量为2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卡托普利(E)是用于治疗各种原发性高血压的药物,其合成路线如下:

(1)A的系统命名为____________,B中官能团的名称是________,B→C的反应类型是________。
(2)C→D转化的另一产物是HCl,则试剂X的分子式为________。
(3)D在NaOH醇溶液中发生消去反应,经酸化后的产物Y有多种同分异构体,写出同时满足下列条件的物质Y的同分异构体的结构简式:_______________、______________________________。
a.红外光谱显示分子中含有苯环,苯环上有四个取代基且不含甲基
b.核磁共振氢谱显示分子内有6种不同环境的氢原子
c.能与FeCl3溶液发生显色反应
(4)B在氢氧化钠溶液中的水解产物酸化后可以发生聚合反应,写出该反应的化学方程式:_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向10mL![]() NH4Al(SO4)2溶液中,滴加等浓度Ba(OH)2溶液x mL,下列叙述正确的是
NH4Al(SO4)2溶液中,滴加等浓度Ba(OH)2溶液x mL,下列叙述正确的是
A. x=10时,溶液中有NH4+、Al3+、SO42-,且c(NH4+)>c(Al3+)
B. x=10时,溶液中有NH4+、AlO2-、SO42-,且 c(NH4+)>c(SO42-)
C. x=30时,溶液中有Ba2+、AlO2-、OH-,且 c(OH-)<c AlO2-)
D. x=30时,溶液中有Ba2+、Al3+、OH-,且 c(OH-)=c(Ba2+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组粒子,互为同位素的是_____(填编号,下同),互为同素异形体的是_______,互为同分异构体的是__________,属于同一种物质的是___________。
① 16O2和18O3 ②质子数相同而中子数不同的两种粒子
③H D T ④ ⑤正丁烷和异丁烷
⑤正丁烷和异丁烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示(B中冷却装置未画出),将氯气和空气(不参与反应)以体积比约1∶3混合通入含水8%的碳酸钠中制备Cl2O,并用水吸收Cl2O制备次氯酸溶液。
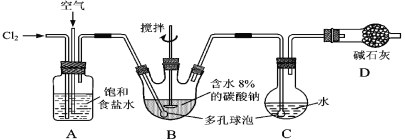
已知:Cl2O极易溶于水并与水反应生成HClO;Cl2O的沸点为3.8 ℃,42 ℃以上分解为Cl2和O2。
(1)①实验中控制氯气与空气体积比的方法是____________________________。
②为使反应充分进行,实验中采取的措施有______________________________。
③装置D的作用是______________________________。
(2)①装置B中产生Cl2O的化学方程式为:____________________________________。
②若B无冷却装置,则进入C中的Cl2O会大量减少。其原因是_____________________。
(3)装置C中采用棕色圆底烧瓶是因为______________________________________。
(4)已知次氯酸可被H2O2、FeCl2等物质还原成Cl-。测定C中次氯酸溶液的物质的量浓度的实验方案为:用______(填“酸”或“碱”)式滴定管取20.00 mL次氯酸溶液,加入足量的______,再加入足量的______,过滤,洗涤沉淀,在真空干燥箱中干燥,用电子天平称量沉淀质量。 (可选用的试剂:H2O2溶液、FeCl2溶液、AgNO3溶液)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表示下列反应的离子方程式正确的是
A. 磁性氧化铁溶于稀硝酸:3Fe2++4H++ NO 3-![]() 3Fe3++NO↑+3H2O
3Fe3++NO↑+3H2O
B. 用浓盐酸与MnO2反应制取少量氯气:MnO2+2H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
C. 向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O![]() Al(OH)3↓+HCO3-
Al(OH)3↓+HCO3-
D. 在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3![]() 2FeO42-+3Cl-+H2O+4H+
2FeO42-+3Cl-+H2O+4H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com