
【题目】有下列物质:①O2 ②CO2 ③NH3 ④Na2O ⑤Na2O2 ⑥NaOH ⑦MgCl2 ⑧H2O2 ⑨NH4Cl ⑩N2,回答下列问题:
(1)只含有极性键的是__;只含有非极性键的是__;只含有离子键的离子化合物是___;含有非极性键的离子化合物是____。(均填序号)
(2)写出⑤、⑨的电子式_____、______
(3)用电子式表示MgCl2的形成过程:____________。
【答案】②③ ①⑩ ④⑦ ⑤ ![]()
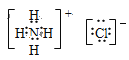
![]()
【解析】
(1)①O2中只含非极性键,属于单质;
②CO2中只含极性键,属于共价化合物;
③NH3中只含极性键,属于共价化合物;
④Na2O中只含离子键,属于离子化合物;
⑤Na2O2中含有离子键和非极性键,属于离子键化合物;
⑥NaOH中含有离子键和极性键,属于离子键化合物;
⑦MgCl2中只含离子键,属于离子化合物;
⑧H2O2含有H-O极性键和O-O非极性键,属于共价化合物;
⑨NH4Cl中含有离子键和极性键,属于离子键化合物;
⑩N2中只含非极性键,属于单质。
(1)只含有极性键的是②③;只含有非极性键的是①⑩;只含有离子键的离子化合物是④⑦;含有非极性键的离子化合物是⑤,故答案为:②③;①⑩;④⑦;⑤。
(2)⑤Na2O2为含有共价键的离子化合物,钠原子与过氧根离子之间形成离子键,过氧根离子中氧原子与氧原子之间形成共价键,电子式为![]() ,⑨NH4Cl为含有共价键的离子化合物,铵根离子与氯离子之间形成离子键,铵根离子中N原子与H原子之间形成共价键,电子式为
,⑨NH4Cl为含有共价键的离子化合物,铵根离子与氯离子之间形成离子键,铵根离子中N原子与H原子之间形成共价键,电子式为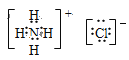 ,故答案为:
,故答案为:![]() ,
,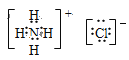 。
。
(3)MgCl2为离子化合物,用电子式表示其形成过程为:![]() ,故答案为:
,故答案为:![]() 。
。


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】一种以含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)为原料制取醋酸镍的工艺流程图如下:

相关离子生成氢氧化物的pH和相关物质的溶解性如下表:
金属离子 | 开始沉淀的pH | 沉淀完全的pH | 物质 | 20℃时溶解性(H2O) |
Fe3+ | 1.1 | 3.2 | CaSO4 | 微溶 |
Fe2+ | 5.8 | 8.8 | NiF | 可溶 |
A13+ | 3.0 | 5.0 | CaF2 | 难溶 |
Ni2+ | 6.7 | 9.5 | NiCO3 | Ksp=9.60×10-6 |
(1)调节pH步骤中,溶液pH的调节范围是______________。
(2)滤渣1和滤渣3主要成分的化学式分别是_____________、__________________。
(3)酸浸过程中,1 molNiS失去6NA个电子,同时生成两种无色有毒气体。写出该反应的化学方程式________________________________。
(4)沉镍过程中,若c(Ni2+)=2.0mol·L-1,欲使100mL该滤液中的Ni2+沉淀完全[c(Ni2+)≤10-5 mol·L-1,则需要加入Na2CO3固体的质量最少为_________g。(保留小数点后1位有效数字)。
(5)保持其他条件不变,在不同温度下对含镍废料进行酸浸,镍浸出率随时间变化如图。酸浸的最佳温度与时间为_______________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里需用480 mL 0.5 mol·L-1的NaOH溶液。
(1)该同学应选择________ mL的容量瓶。
(2)其操作步骤如下图所示,则如图操作应在下图中的__________(填选项字母)之间。

A.②与③ B.①与② C.④与⑤
(3)该同学应称取NaOH固体________g,用质量为23.1 g的烧杯放在托盘天平上称取所需NaOH固体时,请在附表中选取所需的砝码大小________(填字母),并在下图中选出能正确表示游码位置的选项________(填字母)。

(4)下列操作对所配溶液的浓度偏大的有(填写下列序号)(_________)
①转移完溶液后未洗涤玻璃棒和烧杯 ②容量瓶中原来有少量蒸馏水
③摇匀后发现液面低于刻度线再加水 ④定容时观察液面俯视
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. 电子云图中的小黑点密表示该核外空间的电子多
B. 电子排布式 1s22s22px2违反了洪特规则
C. 原子序数为7、8、9的三种元素,其第一电离能和电负性均依次增大
D. 元素周期表中Fe处于ds区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某温度时,在一个10L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示.根据下图中数据填空:

(1)平衡时容器内混合气体密度比起始时_____(填“变大”,“变小”或“相等”下同),混合气体的平均相对分子质量比起始时_____;
(2)将amolX与b mol Y的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:n(X)=n(Y)=2n(Z),则原混合气体中a:b=_____。
Ⅱ.在恒温恒容的密闭容器中,当下列物理量不再发生变化时:①混合气体的压强 ②混合气体的密度 ③混合气体的总物质的量 ④混合气体的平均相对分子质量 ⑤混合气体的颜色 ⑥各反应物或生成物的反应速率之比等于化学计量数之比。
(1)一定能证明2SO2(g)+O2(g)![]() 2SO3(g)达到平衡状态的是_____(填序号,下同)。
2SO3(g)达到平衡状态的是_____(填序号,下同)。
(2)一定能证明I2(g)+H2(g)![]() 2HI(g)达到平衡状态的是______。
2HI(g)达到平衡状态的是______。
(3)一定能证明A(s)+2B(g)![]() C(g)+D(g)达到平衡状态的是_____。(注:B,C,D均为无色物质)
C(g)+D(g)达到平衡状态的是_____。(注:B,C,D均为无色物质)
查看答案和解析>>
科目:高中化学 来源: 题型:
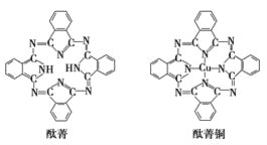
【题目】石墨烯具有原子级的厚度、优异的电学性能、出色的化学稳定性和热力学稳定性。制备石墨烯方法有石墨剥离法、化学气相沉积法等。石墨烯的球棍模型及分子结构示意图如下:

(1)下列有关石墨烯说法正确的是________。
A.石墨烯的结构与金刚石相似
B.石墨烯分子中所有原子可以处于同一平面
C.12 g石墨烯含σ键数为NA
D.从石墨剥离得石墨烯需克服石墨层与层之间的分子间作用力
(2)化学气相沉积法是获得大量石墨烯的有效方法之一,催化剂为金、铜、钴等金属或合金,含碳源可以是甲烷、乙炔、苯、乙醇或酞菁等中的一种或任意组合。
①钴原子在基态时,核外电子排布式为________。
②乙醇沸点比氯乙烷高,主要原因是_______________________。
③下图是金与铜形成的金属互化物合金,它的化学式可表示为:________。
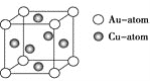
④含碳原子且属于非极性分子的是________;
a.甲烷 b.乙炔 c.苯 d.乙醇
⑤酞菁与酞菁铜染料分子结构如下图,酞菁分子中氮原子采用的杂化方式有:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】证明卤族元素的非金属性强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检查)。
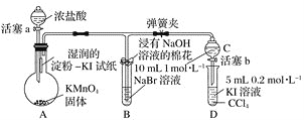
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.……
(1)验证氯气的氧化性强于碘的实验现象是________________________________________。
(2)B中溶液发生反应的离子方程式是____________________________________________。
(3)为验证溴的氧化性强于碘,过程 Ⅳ 的操作和现象是____________________________。
(4)过程Ⅲ实验的目的是________________________________________________________。
(5)氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下,原子半径逐渐________,得电子能力逐渐________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列装置属于原电池的是___________;
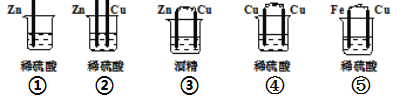
(2)在选出的原电池中,______ 是负极,发生______(氧化、还原) 反应 ,______ 是正极 ,该极的现象___________________________;
(3)在该原电池的内电路中,硫酸根离子移向_________(正、负)极。
(4)此原电池反应的化学方程式为___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com