
【题目】下列有关细胞中水的叙述,错误的是
A. 细胞内参与物质运输的水是自由水
B. 越冬的动物体内结合水的比例相对较高
C. 同一个体的不同器官的含水量相同
D. 植物蒸腾作用中失去的水主要是自由水
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】请按要求填空:
(1)Mg是第3周期元素,该周期部分元素氟化物的熔点见下表:

①解释表中氟化物熔点差异的原因:
a._____________________________________________________________________。
b.____________________________________________________________________。
②硅在一定条件下可以与Cl2反应生成SiCl4,试判断SiCl4的沸点比CCl4的________(填“高”或“低”),理由________________________________。
(2)下列物质变化,只与范德华力有关的是_________。
a.干冰熔化 b.乙酸汽化 c.石英熔融 d.HCONHCH2CH3溶于水 e.碘溶于四氯化碳
(3)C,N元素形成的新材料具有如下图所示结构,该晶体的化学式为:_____________。

(4)FeCl3常温下为固体,熔点282 ℃,沸点315 ℃,在300 ℃以上升华。易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断FeCl3的晶体类型为_________________。
(5)氮化碳和氮化硅晶体结构相似,是新型的非金属高温陶瓷材料,它们的硬度大,熔点高、化学性质稳定。
①氮化硅的硬度________(“大于”或“小于”)氮化碳的硬度,原因是________________。
②下列物质熔化时所克服的微粒间的作用力与氮化硅熔化时所克服的微粒间的作用力相同的是_________。
a.单质I2和晶体硅 b.冰和干冰
c.碳化硅和二氧化硅 d.石墨和氧化镁
③已知氮化硅的晶体结构中,原子间都以单键相连,且氮原子与氮原子不直接相连、硅原子与硅原子不直接相连,同时每个原子都满足8电子稳定结构,请写出氮化硅的化学式________。
(6)第ⅢA,ⅤA元素组成的化合物GaN、GaP、GaAs等是人工合成的新型半导体材料,其晶体结构与单晶硅相似。在GaN晶体中,每个Ga原子与______个N原子相连,与同一个Ga原子相连的N原子构成的空间构型为________。在四大晶体类型中,GaN属于____晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有0.2mol某有机物和0.5mol氧气在一密闭容器中燃烧得产物为CO2、CO、H2O(气)。产物依次通过浓硫酸时,浓硫酸的质量增加了 10.8g;再通过灼热的氧化铜时,氧化铜的质量减轻了 3.2g;又通过碱石灰时,碱石灰的质量增加了 17.6g。该有机物的化学式是
A. C2H4 B. C2H6O C. C2H6O2 D. C3H6O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向10mL![]() NH4Al(SO4)2溶液中,滴加等浓度Ba(OH)2溶液x mL,下列叙述正确的是
NH4Al(SO4)2溶液中,滴加等浓度Ba(OH)2溶液x mL,下列叙述正确的是
A. x=10时,溶液中有NH4+、Al3+、SO42-,且c(NH4+)>c(Al3+)
B. x=10时,溶液中有NH4+、AlO2-、SO42-,且 c(NH4+)>c(SO42-)
C. x=30时,溶液中有Ba2+、AlO2-、OH-,且 c(OH-)<c AlO2-)
D. x=30时,溶液中有Ba2+、Al3+、OH-,且 c(OH-)=c(Ba2+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究小组设计用含氯的有机物A合成棉织物免烫抗皱整理剂M的路线如下(部分反应试剂和条件未注明):

已知:①E的分子式为C5H8O4,能发生水解反应,核磁共振氢谱显示E分子内有2种不同化学环境的氢原子,其个数比为3∶1;

(R、R′、R″代表相同或不相同的烃基)。
(1)A分子中的含氧官能团的名称是________________。
(2)D→E反应的化学方程式是____________。
(3)A→B反应所需的试剂是________________。
(4)G→H反应的化学方程式是____________。
(5)已知1 mol E与2 mol J反应生成1 mol M,则M的结构简式是________。
(6)E的同分异构体有下列性质:①能与NaHCO3反应生成CO2;②能发生水解反应,且水解产物之一能发生银镜反应,则该同分异构体共有________种,其中任意1种的结构简式是________。
(7)J可合成高分子化合物,该高分子化合物的结构简式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示(B中冷却装置未画出),将氯气和空气(不参与反应)以体积比约1∶3混合通入含水8%的碳酸钠中制备Cl2O,并用水吸收Cl2O制备次氯酸溶液。
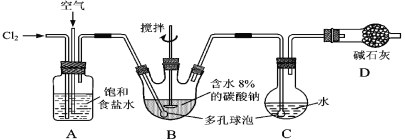
已知:Cl2O极易溶于水并与水反应生成HClO;Cl2O的沸点为3.8 ℃,42 ℃以上分解为Cl2和O2。
(1)①实验中控制氯气与空气体积比的方法是____________________________。
②为使反应充分进行,实验中采取的措施有______________________________。
③装置D的作用是______________________________。
(2)①装置B中产生Cl2O的化学方程式为:____________________________________。
②若B无冷却装置,则进入C中的Cl2O会大量减少。其原因是_____________________。
(3)装置C中采用棕色圆底烧瓶是因为______________________________________。
(4)已知次氯酸可被H2O2、FeCl2等物质还原成Cl-。测定C中次氯酸溶液的物质的量浓度的实验方案为:用______(填“酸”或“碱”)式滴定管取20.00 mL次氯酸溶液,加入足量的______,再加入足量的______,过滤,洗涤沉淀,在真空干燥箱中干燥,用电子天平称量沉淀质量。 (可选用的试剂:H2O2溶液、FeCl2溶液、AgNO3溶液)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 18 g D2O(重水)中含有10NA个质子
B. 78 g苯中含有3NA个C=C双键
C. 1L 0.1mol/L NaHCO3溶液中含有0.1NA个HCO3
D. a g某气体中含分子数为b,c g该气体在标况下的体积为22.4bc/aNAL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是( )
A. 已知2SO2(g)+O2(g)![]() 2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量
2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量
B. 已知C(石墨,s)=C(金刚石,s) ΔH>0,则金刚石比石墨稳定
C. 已知H+(aq)+OH-(aq)=H2O(l)ΔH=-57.3 kJ/mol,代表任何酸碱反应的中和热都是ΔH=-57.3 kJ/mol
D. 已知2C(s)+2O2(g)=2CO2(g) ΔH1,2C(s)+O2(g)=2CO(g) ΔH2,则ΔH1<ΔH2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com