
【题目】已知可逆反应:M(g)+N(g)![]() P(g)+Q(g) ΔH>0,请回答下列问题:
P(g)+Q(g) ΔH>0,请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为:c(M)=1 mol·L-1,c(N)=2.4 mol·L-1;5 min后反应达到平衡,M的转化率为60%,此时N的转化率为________;用M表示的反应速率为________;该温度下反应的平衡常数K=________。
(2)若反应温度升高,M的转化率________(填“增大”“减小”或“不变”)。
(3)若反应温度不变,反应物的起始浓度分别为:c(M)=4 mol·L-1,c(N)=a mol·L-1;达到平衡后,c(P)=c(N)=2 mol·L-1,a=________。
(4)若反应温度不变,反应物的起始浓度为c(M)=c(N)=b mol·L-1,达到平衡后,M的转化率为________。
【答案】25% 0.12 mol·(L·min)-1 0.5 增大 6 41%
【解析】
(1)依据化学平衡三段式列式计算平衡浓度,结合平衡常数概念计算;
(2)依据温度对化学平衡的影响判断;
(3)化学平衡三段式列式计算起始浓度;
(4)依据化学平衡三段式列式计算,依据转化率的概念计算得到。
(1) 由题意建立如下三段式:
M(g)+ N(g)![]() P(g)+ Q(g)
P(g)+ Q(g)
起始量(mol/L) 1 2.4 0 0
变化量(mol/L)1×0.6=0.6 0.6 0.6 0.6
平衡量(mol/L)0.4 1.8 0.6 0.6
N的转化率为α(N)=![]() ×100%=
×100%=![]() ×100%=25%,用M表示的反应速率υ(M)=
×100%=25%,用M表示的反应速率υ(M)=![]() =
=![]() =0.12 mol·(L·min)-1;该温度下化学平衡常数K=
=0.12 mol·(L·min)-1;该温度下化学平衡常数K=![]() =
=![]() =0.5,故答案为:25%;0.12 mol·(L·min)-1;0.5;
=0.5,故答案为:25%;0.12 mol·(L·min)-1;0.5;
(2)因为该反应热是吸热反应,升高温度,平衡向正反应方向移动,则M的转化率增大,故答案为:增大;
(3) 由题意建立如下三段式:
M(g)+N(g)![]() P(g)+Q(g)
P(g)+Q(g)
起始浓度(mol·L-1): 4 a 0 0
转化浓度(mol·L-1): 2 2 2 2
平衡浓度(mol·L-1): 2 a-2 2 2
由温度不变,平衡常数不变可得K=![]() =0.5,解得得a=6,故答案为:6;
=0.5,解得得a=6,故答案为:6;
(4) 由题意建立如下三段式:
M(g)+N(g)![]() P(g)+Q(g)
P(g)+Q(g)
起始浓度(mol·L-1): b b 0 0
转化浓度(mol·L-1): x x x x
平衡浓度(mol·L-1): (b-x) (b-x) x x
由温度不变,平衡常数不变可得K=![]() =0.5,解得x=0.41b,则M的转化率为α(M)=
=0.5,解得x=0.41b,则M的转化率为α(M)=![]() ×100%=
×100%=![]() ×100%= 41%,故答案为:41%。
×100%= 41%,故答案为:41%。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. 铝粉投入到NaOH溶液中:2Al+2OH-+2H2O══ 2AlO2—+3H2↑
B. AlCl3溶液中加入足量的氨水:Al3++ 3OH- ══ Al(OH)3↓
C. 三氯化铁溶液中加入铁粉![]()
D. FeCl2溶液跟Cl2反应:2Fe2++Cl2=2Fe3++2Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用膜技术原理和电化学原理制备少量硫酸和绿色硝化剂N2O5,装置如图所示,下列说法不正确的是

A. 电极a和电极c都发生氧化反应
B. 电极d的电极反应式为2H++2e-=H2↑
C. c电极上的电极反应式为N2O4-2e-+H2O=N2O5+2H+
D. 装置A中每消耗64gSO2,理论上装置A和装置B中均有2moH+通过质子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应:2SO2(g)+O2(g)![]() 2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
A. 增大压强 B. 升高温度 C. 使用催化剂 D. 多充O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下(已知N2(g)+3H2(g)===2NH3(g) △H=-92.4kJ·mol-1)
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1 mol N2、3 mol H2 | 2 mol NH3 | 4 mol NH3 |
NH3的浓度(mol·L-1) | c1 | c2 | c3 |
反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收 c kJ |
体系压强(Pa) | p1 | p2 | p3 |
反应物转化率 |
|
|
|
下列说法正确的是( )
A. 2c1>c3B. a+b=92.4C. 2p2<p3D. ![]() 1+
1+![]() 3>1
3>1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中序号分别代表某一元素。请回答下列问题。
周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 |
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
(1)①—⑩中,最活泼的金属元素是___________________(写元素符号);最不活泼的元素是_______(写元素符号)。
(2)④、⑤的简单离子,其半径更大的是________(写离子符号)。
(3)⑧、⑨的气态氢化物,更稳定的是_________(填化学式)。
(4)元素的非金属性:①_______⑦(填“>”或“<”)。
(5)①—⑨的最高价氧化物的水化物中:酸性最强的是___________(填化学式),既能与酸反应又能与碱反应的是___________(填化学式).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.Fe3+的最外层电子排布式为![]()
B.基态原子的能量一定比激发态原子的能量高
C.基态碳原子价电子的轨道表示式:![]()
![]()
D.基态多电子原子中,P轨道电子能量一定比s轨道电子能量高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M( )是合成药物瑞德西韦的中间体,其合成途径如图:
)是合成药物瑞德西韦的中间体,其合成途径如图:

已知:![]() +HCN→
+HCN→ (R和R′均表示烃基或氢原子)
(R和R′均表示烃基或氢原子)
完成下列填空:
(1)M中含氧官能团的名称为___。反应①~③中属于取代反应的有___。反应⑤的化学方程式为___。
(2)反应④需要在无水条件下进行,如何检验反应③所得产物中的水已被除净?___。
(3)写出两种满足下列条件的有机物的结构简式___。
①(C2H5)2CHOH的同分异构体,②能发生消除反应且只生成一种烯烃。
(4)聚甲基丙烯酸( )常用作胶黏剂、锅炉阻垢剂以及合成离子交换树脂。根据已有知识并结合题目流程中的信息,设计由丙酮(
)常用作胶黏剂、锅炉阻垢剂以及合成离子交换树脂。根据已有知识并结合题目流程中的信息,设计由丙酮(![]() )制备甲基丙烯酸(
)制备甲基丙烯酸(![]() )的合成路线___。
)的合成路线___。
(合成路线常用的表示方式为:A![]() B
B![]() 目标产物)
目标产物)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
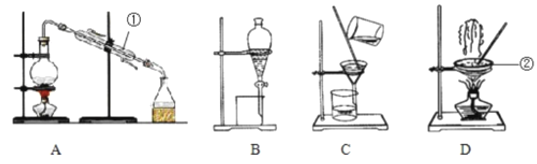
(1)除去自来水中的Ca2+、Mg2+、Cl-、SO42-等杂质,选择装置___(填代表装置图的字母)。
(2)用CCl4萃取碘水中的I2,有机层的颜色为___。
(3)装置A中①的名称是___,进水的方向是___,装置B在分液时为使液体顺利滴下,应进行的具体操作是___。
(4)海水中蕴藏着丰富的资源。在实验室中取少量海水,进行如下流程的实验: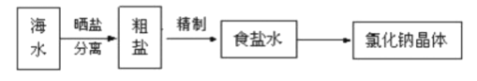
问题:粗盐中含Ca2+、Mg2+、Fe3+、SO42-等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有:①加入过量的Na2CO3溶液;②加入过量的BaCl2溶液;③加入过量的NaOH溶液④调节溶液的pH等于7:⑤溶解;⑥过滤;⑦蒸发。
正确的操作顺序是___(填写字母)。
a.⑤②③①⑥④⑦ b.⑤①②③⑥④⑦ c.⑤③②①⑥④⑦ d.⑤②①③⑥④⑦
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com