
| A、Ba(OH)2?8H2O与NH4Cl反应 |
| B、铝与稀盐酸 |
| C、灼热的炭与水蒸气生成一氧化碳和氢气的反应 |
| D、煤与O2的燃烧反应 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢氧化钠固体 |
| B、硝酸钠溶液 |
| C、硫酸钾溶液 |
| D、碳酸钠固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、A<B<C |
| B、B<C<A |
| C、B<A<C |
| D、C<A<B |
查看答案和解析>>
科目:高中化学 来源: 题型:
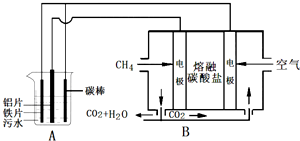
| A、装置A中碳棒为阴极 |
| B、装置B中通入空气的电极反应是O2+2H2O+4e-═4OH- |
| C、污水中加入适量的硫酸钠,既可增强溶液的导电性,又可增强凝聚净化的效果 |
| D、标准状况下,若A装置中产生44.8L气体,则理论上B装置中要消耗CH4 11.2L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、先加稀盐酸将溶液酸化,再滴加氯化钡溶液,看是否生成白色沉淀 |
| B、先加稀硝酸将溶液酸化,再滴加氯化钡溶液,看是否生成白色沉淀 |
| C、直接向溶液中滴加稀硝酸酸化过的氯化钡溶液,看是否生成白色沉淀 |
| D、直接向溶液中滴加稀盐酸酸化过的氯化钡溶液,看是否生成白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、把过量碳酸氢钠溶液加入到氢氧化钡溶液中:2HCO3-+Ba2++2OH-═BaCO3↓+CO32-+2H2O |
| B、向KHSO4溶液中加入Ba(OH)2溶液至所得溶液的pH=7(常温时):Ba2++OH-+H++SO42-═BaSO4↓+H2O |
| C、将少量SO2气体通入NaClO溶液中:SO2+2ClO-+H2O═SO32-+2HClO |
| D、标况下112mL Cl2通入10mL 1mol/L的FeBr2溶液:2Fe2++4Br-+3Cl2═2Fe3++6Cl-+2Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、可形成-l价离子 |
| B、从上到下原子半径逐渐减小 |
| C、从上到下原子半径逐渐增大 |
| D、从上到下非金属性逐渐减弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com