
大气中的部分碘源于O3对海水中I-的氧化。将O3持续通入NaI溶液中进行模拟研究。
(1)O3将I-氧化成I2的过程由3步反应组成:
①I-(aq)+ O3(g)=IO-(aq)+O2(g) △H1
②IO-(aq)+H+(aq)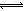 HOI(aq) △H2
HOI(aq) △H2
③HOI(aq)+ I-(aq)+ H+(aq)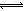 I2(aq)+H2O(l)
△H3
I2(aq)+H2O(l)
△H3
总反应的化学方程式为______,其反应△H=______。
(2)在溶液中存在化学平衡:I2(aq)+I-(aq)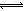 I3-(aq),其平衡常数表达式为_______。
I3-(aq),其平衡常数表达式为_______。
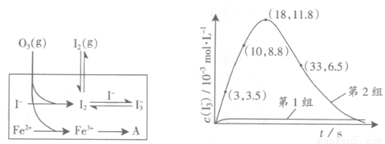
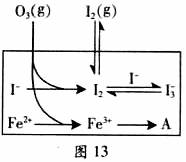
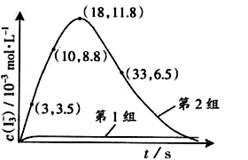
(3)为探究Fe2+对氧化I-反应的影响(反应体系如图),某研究小组测定两组实验中I3-浓度和体系pH,结果见图和下表。
|
编号 |
反应物 |
反应前pH |
反应后pH |
|
第1组 |
O3+ I- |
5.2 |
11.0 |
|
第2组 |
O3+ I-+ Fe2+ |
5.2 |
4.1 |
①第1组实验中,导致反应后pH升高的原因是_______。
②图13中的A为 。由Fe3+生成A的过程能显著提高I-的转化率,原因是_______。
③第2组实验进行18s后,I3-下降。导致下降的直接原因有(双选)______。
A.c(H+)减小 B.c(I-)减小 C.I2(g)不断生成 D.c(Fe3+)增加
(4)据图14,计算3~18s内第2组实验中生成I3-的平均反应速率(写出计算过程,结果保留两位有效数字)。
(1)2NaI+O3+H2SO4 Na2SO4+I2+O2+H2O(2分,其他合理答案也给分)
Na2SO4+I2+O2+H2O(2分,其他合理答案也给分)
△H1+△H2+△H3(1分)
(2) 或c(I3-)/[c(I2)?c(I-)](2分)
或c(I3-)/[c(I2)?c(I-)](2分)
(3)①臭氧将碘离子氧化为I2的离子方程式为2 I-+O3+2H+ I2+O2(g)+H2O,既消耗氢离子又生成水,导致溶液的酸性减弱、pH升高(或者O3将I-氧化成I2的②③步反应为IO-(aq)+H+(aq)
I2+O2(g)+H2O,既消耗氢离子又生成水,导致溶液的酸性减弱、pH升高(或者O3将I-氧化成I2的②③步反应为IO-(aq)+H+(aq)
 HOI(aq)、HOI(aq)+ I-(aq)+ H+(aq)
HOI(aq)、HOI(aq)+ I-(aq)+ H+(aq) I2(aq)+H2O(l),它们不仅消耗氢离子,而且还生成了水)(2分,其他合理表达也给分)
I2(aq)+H2O(l),它们不仅消耗氢离子,而且还生成了水)(2分,其他合理表达也给分)
②Fe2+(1分) 因为Fe3+可以将I-直接氧化成I2或2Fe3++2I-==2Fe2++I2,使溶液中c(I2)增大,促使I2(aq)+I-(aq) I3-(aq)的平衡右移,消耗的c(I-)增多(2分,其他合理说法也给分)
I3-(aq)的平衡右移,消耗的c(I-)增多(2分,其他合理说法也给分)
③BC(3分,错选不给分,少选且选对给1分)
(4)生成I3-的平均反应速率v(I3-)= =
= ≈5.5×10-4mol/(L?s)(3分,其他合理答案也给分)
≈5.5×10-4mol/(L?s)(3分,其他合理答案也给分)
【解析】
(1)臭氧将碘离子氧化成碘单质的过程由3步反应组成,观察已知3个热化学方程式中的反应物和生成物,不难发现①+②+③不仅可以约去中间产物或中间反应物[如IO-(aq)、HOI(aq)],而且可得总反应的热化学方程式,即2
I-(aq)+ O3(g) +2H+(aq)  I2(aq) +O2(g)+H2O(l),根据盖斯定律可得其焓变△H=△H1+△H2+△H3;氢离子表示强酸,如硫酸等,将臭氧持续通入NaI溶液中,总反应的化学方程式可以是2NaI+O3+H2SO4
I2(aq) +O2(g)+H2O(l),根据盖斯定律可得其焓变△H=△H1+△H2+△H3;氢离子表示强酸,如硫酸等,将臭氧持续通入NaI溶液中,总反应的化学方程式可以是2NaI+O3+H2SO4 Na2SO4+I2+O2+H2O或2NaI+O3+H2SO4===Na2SO4+I2+O2+H2O等;
Na2SO4+I2+O2+H2O或2NaI+O3+H2SO4===Na2SO4+I2+O2+H2O等;
(2)由化学平衡常数定义式可得,I2(aq)+ I-(aq) I3-(aq)的平衡常数表达式为
I3-(aq)的平衡常数表达式为 或c(I3-)/[c(I2)?c(I-)];
或c(I3-)/[c(I2)?c(I-)];
(3)①导致前者反应后pH升高的原因是臭氧将碘离子氧化为I2的总反应的离子方程式为2I-+O3+2H+ I2+O2(g)+H2O(或者第②③步反应的反应物中都有氢离子,第③步反应的生成物中有水),既消耗氢离子又生成水,导致溶液的酸性减弱、pH升高;②第一组实验无催化剂,O3将I-氧化成I2分3步进行,第②③步反应都是可逆反应,因此I-的转化率很小;第二组实验有催化剂,能加快反应速率,改变反应的路径,使发生反应所需活化能降低,催化剂的加入将总反应的离子方程式(2I-+O3+2H+
I2+O2(g)+H2O(或者第②③步反应的反应物中都有氢离子,第③步反应的生成物中有水),既消耗氢离子又生成水,导致溶液的酸性减弱、pH升高;②第一组实验无催化剂,O3将I-氧化成I2分3步进行,第②③步反应都是可逆反应,因此I-的转化率很小;第二组实验有催化剂,能加快反应速率,改变反应的路径,使发生反应所需活化能降低,催化剂的加入将总反应的离子方程式(2I-+O3+2H+ I2+O2+H2O)一分为二,先后反应的离子方程式为2Fe2++O3+2H+==2Fe3++O2+H2O、2Fe3++2I-==2Fe2++I2,且催化剂在反应前后的总质量保持不变,因此图13中A为Fe2+;虽然催化剂(或Fe2+)不能使总反应2 I-(aq)+ O3(g)
+2H+(aq)
I2+O2+H2O)一分为二,先后反应的离子方程式为2Fe2++O3+2H+==2Fe3++O2+H2O、2Fe3++2I-==2Fe2++I2,且催化剂在反应前后的总质量保持不变,因此图13中A为Fe2+;虽然催化剂(或Fe2+)不能使总反应2 I-(aq)+ O3(g)
+2H+(aq)  I2(aq) +O2(g)+H2O(l)所达平衡移动,但是它改变反应的路径,由铁离子生成亚铁离子的过程能显著提高碘离子的转化率的原因是Fe3+可以将I-直接氧化成I2或2Fe3++2I-==2Fe2++I2,使溶液中c(I2)增大,进而使I2(aq)+I-(aq)
I2(aq) +O2(g)+H2O(l)所达平衡移动,但是它改变反应的路径,由铁离子生成亚铁离子的过程能显著提高碘离子的转化率的原因是Fe3+可以将I-直接氧化成I2或2Fe3++2I-==2Fe2++I2,使溶液中c(I2)增大,进而使I2(aq)+I-(aq) I3-(aq)的平衡右移,二者导致消耗的c(I-)增多;③对比表格中第1、2组实验前后pH可得,第1组pH增大,c(H+)减小,图中第1组实验所得I3-浓度曲线先略为增大后几乎不变,第2组pH减小,c(H+)增大,图中第2组实验所得I3-浓度曲线先显著增大后逐渐减小至无,根据上述分析可得,若c(H+)减小,I3-浓度不会下降,A项错误;若c(I-)减小,则反应③HOI(aq)+I-(aq)+H+(aq)
I3-(aq)的平衡右移,二者导致消耗的c(I-)增多;③对比表格中第1、2组实验前后pH可得,第1组pH增大,c(H+)减小,图中第1组实验所得I3-浓度曲线先略为增大后几乎不变,第2组pH减小,c(H+)增大,图中第2组实验所得I3-浓度曲线先显著增大后逐渐减小至无,根据上述分析可得,若c(H+)减小,I3-浓度不会下降,A项错误;若c(I-)减小,则反应③HOI(aq)+I-(aq)+H+(aq) I2(aq)+H2O(l)的平衡左移,c(I2)也减小,导致I2(aq)+I-(aq)
I2(aq)+H2O(l)的平衡左移,c(I2)也减小,导致I2(aq)+I-(aq) I3-(aq)的平衡左移,所以I3-浓度下降,B项正确;若I2(g)不断生成,导致I2(aq)
I3-(aq)的平衡左移,所以I3-浓度下降,B项正确;若I2(g)不断生成,导致I2(aq) I2(g)的溶解平衡右移,既使溶液中c(I2)减小,又使 I2(aq)+I-(aq)
I2(g)的溶解平衡右移,既使溶液中c(I2)减小,又使 I2(aq)+I-(aq) I3-(aq)的平衡左移,则I3-浓度下降,C项正确;若c(Fe3+)增加,Fe3+将I-直接氧化成I2或发生反应2Fe3++2I-==2Fe2++I2,则溶液中c(I2)增大,而海水中c(I-)略为减小或忽略不计,导致I2(aq)+I-(aq)
I3-(aq)的平衡左移,则I3-浓度下降,C项正确;若c(Fe3+)增加,Fe3+将I-直接氧化成I2或发生反应2Fe3++2I-==2Fe2++I2,则溶液中c(I2)增大,而海水中c(I-)略为减小或忽略不计,导致I2(aq)+I-(aq) I3-(aq)的平衡右移,I3-浓度增大,D项错误;
I3-(aq)的平衡右移,I3-浓度增大,D项错误;
(4)读图14,3~18s内第2组实验中I3-浓度由 3.5×10-3mol/L增加到11.8×10-3mol/L,则生成I3-的平均反应速率v(I3-)= =
= ≈5.5×10-4mol/(L?s),此问需要注意纵坐标中 “c(I3-)/ 10-3mol?L-1”隐含的信息,计算时需要图中所得数据乘以“×10-3 mol?L-1”。
≈5.5×10-4mol/(L?s),此问需要注意纵坐标中 “c(I3-)/ 10-3mol?L-1”隐含的信息,计算时需要图中所得数据乘以“×10-3 mol?L-1”。
【考点定位】本题以大气中的部分碘源于O3对海水中I-的氧化为背景考查了考生对中学化学的重要原理掌握情况;考查考生对热化学方程式含义、盖斯定律的理解,以及利用盖斯定律进行有关反应热计算的能力。考查考生对化学反应可逆性、平衡常数表达式的书写的理解程度;考查考生考查考生正确判断、解释和说明有关化学现象和问题的能力;考查考生对浓度、催化剂等外界因素对平衡移动的影响等知识的理解;考查考生读解图表、提取信息的能力;考查考生对化学反应速率概念、计算方法以及影响速率的因素的了解和理解。


科目:高中化学 来源: 题型:阅读理解
 I2+O2+H2O
I2+O2+H2O I2+O2+H2O
I2+O2+H2O


| 编号 | 反应物 | 反应前pH | 反应后pH |
| 第1组 | O3+I- | 5.2 | 11.0 |
| 第2组 | O3+I-+Fe2- | 5.2 | 4.1 |
 I2+O2+H2O可知消耗酸,所以pH升高
I2+O2+H2O可知消耗酸,所以pH升高 I2+O2+H2O可知消耗酸,所以pH升高
I2+O2+H2O可知消耗酸,所以pH升高查看答案和解析>>
科目:高中化学 来源: 题型:
大气中的部分碘源于O3对海水中I-的氧化。将O3持续通入NaI溶液中进行模拟研究. ks5u
 (1)O3将I-氧化成I2的过程由3步反应组成:
(1)O3将I-氧化成I2的过程由3步反应组成:
①I-(aq)+ O3(g)= IO-(aq)+O2(g)△H1
②IO-(aq)+H+(aq) ![]() HOI(aq) △H2
HOI(aq) △H2
③HOI(aq) + I-(aq) + H+(aq) ![]() I2(aq) + H2O(l) △H3
I2(aq) + H2O(l) △H3
总反应的化学方程式为__ ____,其反应△H=___ ___
(2)在溶液中存在化学平衡:I2(aq) + I-(aq) ![]() I3-(aq),其平衡常数表达式为_______.
I3-(aq),其平衡常数表达式为_______.
 (3) 为探究Fe2+ 对O3氧化I-反应的影响(反应体如图13),某研究小组测定两组实验中I3-浓度和体系pH,结果见图14和下表。
(3) 为探究Fe2+ 对O3氧化I-反应的影响(反应体如图13),某研究小组测定两组实验中I3-浓度和体系pH,结果见图14和下表。
图14
①第1组实验中,导致反应后pH升高的原因是_______。
②图13中的A为__ ___,由Fe3+生成A的过程能显著提高Ⅰ-的转化率,原因是____ ___.
③第2组实验进行18s后,I3-浓度下降。导致下降的直接原因有(双选)______。
A.c(H+)减小 B.c(I-)减小 C. I2(g)不断生成 D. c(Fe3+)增加
(4)据图14,计算3-18s内第2组实验中生成I3-的平均反应速率(写出计算过程,结果保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年浙江省嘉兴市高三教学测试(一)理综化学试卷(解析版) 题型:填空题
大气中的部分碘源于O3对海水中Iˉ的氧化。将O3持续通入NaI酸性溶液溶液中进行模拟研究。
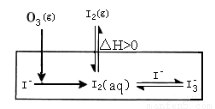
(1)O3将Iˉ氧化成I2的过程可发生如下反应:
①Iˉ(aq)+ O3(g)= IOˉ(aq) + O2(g) △H1
②IOˉ(aq)+H+(aq)  HOI(aq) △H2
HOI(aq) △H2
③HOI(aq) + Iˉ(aq) + H+(aq)  I2(aq) + H2O(l)? △H3
I2(aq) + H2O(l)? △H3
④O3(g)+2Iˉ(aq)+2H+(aq)= I2(aq) + O2(g)+ H2O(l)? △H4
则△H3与△H1、△H2、△H4之间的关系是:△H3? = ????? 。
(2)在溶液中存在化学平衡: I2(aq) + Iˉ(aq)  I3ˉ(aq)其平衡常数表达式为????? 。在反应的整个过程中I3ˉ物质的量浓度变化情况是????? 。
I3ˉ(aq)其平衡常数表达式为????? 。在反应的整个过程中I3ˉ物质的量浓度变化情况是????? 。
(3)为探究温度 对I2(aq) + Iˉ(aq)  I3ˉ(aq)? △H5? 反应的影响。在某温度T1下,将一定量的0.2 mol·L-1NaI酸性溶液置于密闭容器中,并充入一定量的O3(g)(O3气体不足,不考虑生成物O2与 Iˉ反应),在t时刻,测得容器中I2(g)的浓度。然后分别在温度为T2、T3、T4、T5下,保持其它初始实验条件不变,重复上述实验,经过相同时间测得I2(g)浓度,得到趋势图(见图一)。则:
I3ˉ(aq)? △H5? 反应的影响。在某温度T1下,将一定量的0.2 mol·L-1NaI酸性溶液置于密闭容器中,并充入一定量的O3(g)(O3气体不足,不考虑生成物O2与 Iˉ反应),在t时刻,测得容器中I2(g)的浓度。然后分别在温度为T2、T3、T4、T5下,保持其它初始实验条件不变,重复上述实验,经过相同时间测得I2(g)浓度,得到趋势图(见图一)。则:
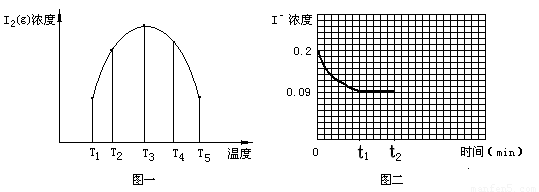
①若在T3时,容器中无O3, T4~T5温度区间容器内I2(g)浓度呈现如图一所示的变化趋势,则△H5????? 0(填>、=或<);该条件下在温度为T4时,溶液中Iˉ浓度随时间变化的趋势曲线如图二所示。在t2时,将该反应体系温度上升到T5,并维持该温度。请在图2中画出t2时刻后溶液中 Iˉ浓度变化总趋势曲线。
??? ②若在T3时,容器中还有O3,则T1~T2温度区间容器内I2(g)浓度呈现如图一所示的变化趋势,其可能的原因是????? 。(任写一点)
(4)利用反应④和图2的信息,计算0-t1时间段内用I2(aq)表示的化学反应速率????? 。
查看答案和解析>>
科目:高中化学 来源:2013年广东省高考化学试卷(解析版) 题型:填空题

| 编号 | 反应物 | 反应前pH | 反应后pH |
| 第1组 | O3+I- | 5.2 | 11.0 |
| 第2组 | O3+I-+Fe2- | 5.2 | 4.1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com