
方案一:检验褪色后溶液的酸碱性;
方案二:检验反应前溴水中Br2的物质的量和反应后溶液中Br-离子的物质的量。
(1)方案一是否可行__________(填“是”或“否”),理由是__________________________。
(2)假设测得反应前溴水中Br2的物质的量为a mol,若测得反应后n(Br-)=_______mol,则说明溴水与乙醛发生取代反应;若测得反应后n(Br-)=___________mol,说明溴水与乙醛发生加成反应;若测得反应后n(Br-)=___________mol,说明溴水将乙醛氧化为乙酸。
(3)按物质的量之比1∶5配成
(4)写出上述测定过程中两个反应的离子方程式:
①KBrO3与KBr在酸性条件下的反应_____________________________________________;
②溴水与乙醛的反应__________________________________________。
(1)否 猜想①和猜想③所得溶液都呈酸性
(2)a 0
(3)③
(4)①![]() +5Br-+6H+====3Br2+3H2O
+5Br-+6H+====3Br2+3H2O
②CH3CHO+Br2+H2O![]() CH3COOH+2Br-+2H+
CH3COOH+2Br-+2H+
解析:(1)猜想①和③所得溶液均呈酸性,检验褪色后溶液的酸碱性不能确定哪种猜想正确。(2)若猜想①正确,CH3CHO+Br2![]()
![]() +HBr,a molBr2完全反应预计产生a mol Br-;若猜想②正确,CH3CHO+Br2
+HBr,a molBr2完全反应预计产生a mol Br-;若猜想②正确,CH3CHO+Br2![]()
![]() ,a mol Br2完全反应Br-应为0 mol;若猜想③正确,CH3CHO+Br2+H2O
,a mol Br2完全反应Br-应为0 mol;若猜想③正确,CH3CHO+Br2+H2O![]() CH3COOH+2HBr,a mol Br2完全反应产生
CH3COOH+2HBr,a mol Br2完全反应产生![]() =0.000 5 mol,AgBr—Br-,n(Br-)=n(AgBr)=
=0.000 5 mol,AgBr—Br-,n(Br-)=n(AgBr)=![]() =0.001 mol,
=0.001 mol,![]() ,猜想③正确。(4)中①,氧化反应为
,猜想③正确。(4)中①,氧化反应为![]()
![]()
![]() Br2,还原反应为Br-
Br2,还原反应为Br-![]()
![]() Br2,1个
Br2,1个![]() 与5个Br-反应时化合价升降相等,此时共生成了分子Br2,进一步配平得反应的离子方程式为
与5个Br-反应时化合价升降相等,此时共生成了分子Br2,进一步配平得反应的离子方程式为![]() +5Br-+6H+====3Br2+3H2O。
+5Br-+6H+====3Br2+3H2O。


 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
| 实验操作步骤 | 实验现象 | 结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
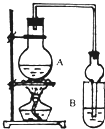 I.下列实验设计、操作或实验现象合理的是
I.下列实验设计、操作或实验现象合理的是| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
课本介绍了乙醇催化氧化的实验。
(1)甲同学用化学方法替代“闻生成物的气味”来说明生成物的出现,该化学方法中所另加的试剂及出现的主要现象是: 。(用所学的知识回答)
(2)甲同学在探究“闻生成物的气味”的替代方法时,偶然发现向溴水中加入足量的乙醛溶液,可以看到溴水褪色。该同学为解释上述现象,提出三种猜想:
①溴与乙醛发生取代反应;② ③由于醛基具有还原性,溴将乙醛氧化为乙酸。
为探究哪种猜想正确,甲同学提出了如下两种实验方案:
方案一:用pH试纸检测溴水褪色后溶液的酸碱性;
方案二:测定反应前溴水中Br2的物质的量和反应后溶液中Br— 离子的物质的量。
(3)甲同学认为:假设测得反应前溴水中Br2的物质的量为amol,若测得反应后
n(Br—)= mol,则说明溴与乙醛发生取代反应。
(4)乙同学设计如下实验方案:
①按物质的量之比为1:5配制KBrO3—KBr溶液,加合适的适量的酸,完全反应并稀释至1L,生成0.5molBr2。
②取上述溶液10mL(含0.005mol Br2)加入足量乙醛溶液,使之褪色,然后将所得溶液稀释为100mL,准确量取其中10mL。
③加入过量的AgNO3溶液,过滤、洗涤、干燥后称量得到淡黄色固体0.188g。(若已知CH3COOAg易溶于水)。
试通过计算判断:溴与乙醛发生反应的化学方程式为
乙同学认为合适的酸既不是硫酸也不是盐酸,这是为什么?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com