
分析 (1)高温下,铁和水蒸气反应生成四氧化三铁和氢气;
(2)根据得失电子守恒,n(Fe)=n(H2),分析求解.
解答 解:(1)高温下,铁和水蒸气反应生成四氧化三铁和氢气,反应方程式为
3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4 +4H2,
232g 4×22.4L
m(Fe3O4) 8.96L
所以$\frac{232g}{m(F{e}_{3}{O}_{4})}=\frac{4×22.4L}{8.96L}$,解之得:m(Fe3O4)=23.2g;
答:铁与水蒸气反应时生成的氧化产物质量是23.2g;
(2)根据得失电子守恒,n(Fe)=n(H2),n(H2)=$\frac{2.24L+8.96L}{22.4L/mol}$=0.5mol,所以最初所用铁粉的质量是0.5mol×56g/mol=28g;
答:最初所用铁粉的质量是28g.
点评 本题考查根据方程式的计算,根据原子守恒得到物质的物质的量之间的关系,根据关系式计算即可,化繁为简,题目难度不大.


科目:高中化学 来源: 题型:解答题
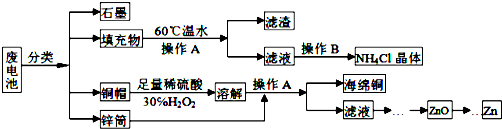
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaCl2溶液 | B. | FeCl2溶液 | C. | FeCl3溶液 | D. | Fe(NO3)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用乙烷和氯气等物质的量混合可以得到纯净的氯乙烷 | |
| B. | 将稀硫酸和无水酒精按3:1的体积比混合加热到170℃制取乙烯 | |
| C. | 将电石和饱和食盐水置于启普发生器中制取乙炔 | |
| D. | 用酸性KMnO4溶液可将己烷和己烯二种无色液体鉴别开来 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
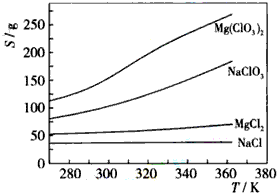 (1)下列有关硅单质及其化合物的说法正确的是B.
(1)下列有关硅单质及其化合物的说法正确的是B.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
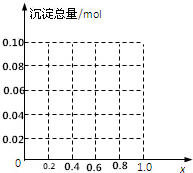 现有AlCl3和FeCl3混合溶液,其中Al3+和Fe3+的物质的量之和为0.1mol,在此溶液中加入90mL浓度为4mol/L的NaOH溶液,使其充分反应,设Al3+的物质的量与总物质的量的比值为x.
现有AlCl3和FeCl3混合溶液,其中Al3+和Fe3+的物质的量之和为0.1mol,在此溶液中加入90mL浓度为4mol/L的NaOH溶液,使其充分反应,设Al3+的物质的量与总物质的量的比值为x.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁粉有剩余,溶液呈浅绿色,Cl-基本保持不变 | |
| B. | 往溶液中滴入无色KSCN溶液,不显红色 | |
| C. | Fe2+和Fe3+物质的量之比为6:1 | |
| D. | 氧化产物和还原产物的物质的量之比为2:5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com