
| A、元素的原子序数:a>b>c>d |
| B、a-b=n-m |
| C、元素的非金属性:R>Z |
| D、最高价氧化物对应的水化物的碱性:X>Y |


 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:
| A、4:1 | B、1:2 |
| C、1:4 | D、3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③⑥ | B、①⑥⑦⑧ |
| C、①②⑧ | D、①③⑤⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、羰基硫的电子式为 |
| B、羰基硫中含有非极性键 |
| C、羰基硫沸点比CO2低 |
| D、羰基硫中硫原子未满足8电子结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等压时,通入惰性气体,Z的物质的量不变 |
| B、等压时,通入Z气体,容器内温度改变 |
| C、等容时,通入惰性气体,反应速率不变 |
| D、等容时,通入Z气体,Y的物质的量浓度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入适量的氢氧化钠固体 |
| B、将溶液稀释到原体积的10倍 |
| C、加入等体积0.2mol?L-1氨水 |
| D、降低溶液的温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HCl HI H2 |
| B、H2S CO2 H2 |
| C、H2 SO2 HCl |
| D、NH3 N2 H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
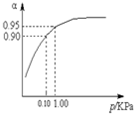 硫酸用途十分广泛,工业上合成硫酸时,将SO2转化为催化氧化是一个关键步骤.请回答下列问题:
硫酸用途十分广泛,工业上合成硫酸时,将SO2转化为催化氧化是一个关键步骤.请回答下列问题:| 催化剂 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com