
【题目】天然同位素原子R的一个原子中共有96个微粒,其中36个微粒不带电,则R的质量数和中子数分别为( )
A.36、30B.66、30C.66、36D.60、30
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列关于氯化氢的叙述中,不正确的是( )
A.氯化氢极易溶于水,能进行喷泉实验B.液态氯化氢不能导电
C.氯化氢在空气中扩散时能形成白烟D.氯化氢能使湿润的蓝色石蕊试纸变红
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 欲使1.6 g氧化铁完全被还原,需要CO的体积为672 mL
B. 直接加热CuO可以得到Cu单质
C. 用磁铁矿炼铁的反应中,1 mol Fe3O4被CO还原成Fe,转移9 mol e-
D. 工业上用电解法制铝,加入冰晶石是为了使氧化铝熔化的温度降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白藜芦醇 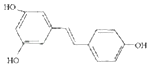 ,广泛存在于食物(例如桑椹、花生、尤其是葡萄)中,它可能具有抗癌性.能够跟1mol该化合物起反应的Br2或H2的最大用量分别是( )
,广泛存在于食物(例如桑椹、花生、尤其是葡萄)中,它可能具有抗癌性.能够跟1mol该化合物起反应的Br2或H2的最大用量分别是( )
A.1mol,1mol
B.3.5mol,7mol
C.3.5mol,6mol
D.6mol,7mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴碘主要存在于海水中,有“海洋元素”的美称。海水中的碘富集在海藻中,我国海带产量居世界第一,除供食用外,大量用于制碘。实验室提取碘的途径如下所示:
![]()
(1)碘元素在海水中以________存在(填“游离态”或“化合态”)。
(2)灼烧过程中用到的实验仪器有铁三角架、酒精灯、______、_____、______。
(3)操作①中需用到玻璃棒,则玻璃棒的作用是_______________。
(4)向酸化后的水溶液加入适量3% H2O2溶液,发生反应的化学方程式为________。
(5)操作③是分液,则操作②是___________;操作④是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氯的说法中错误的是
A. 漂白粉可由Cl2通入消石灰中制备,其有效成分是Ca(ClO)2
B. 新制氯水可使石蕊试液先变红后褪色
C. 氯气在参与的化学反应中只能作为氧化剂
D. 铁在氯气中燃烧没有火焰,产物的水溶液中滴入KSCN溶液显红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在日常生活中,为了达到更好的清洁效果,经常有人会将洁厕液(含有盐酸)与84消毒液混合使用,从而会发生引发中毒的事故。
(1)84消毒液的主要成分是次氯酸钠,写出次氯酸钠的电子式:。
(2)洁厕灵的主要成分是HCl。下列关于卤化氢的性质比较中错误的是
A.酸性:HF>HCl>HBr>HI
B.键能:H—F>H—Cl>H—Br>H—I
C.熔点:HF<HCl<HBr<HI
D.还原性:HF<HCl<HBr<HI
(3)常温下,0.1mol/L的NaClO溶液的pH=9.7,原因。常温下HClO的电离平衡常数为。洁厕液与84消毒液混合后会生成有毒的氯气。写出该反应的离子方程式。
(4)高铁酸钾是一种高效多功能水处理剂,工业上常采用NaClO氧化法生产,反应原理为:
①在碱性条件下,利用NaClO氧化硝酸铁,制得Na2FeO4 , 该反应的离子反应方程式为。
②Na2FeO4与KOH反应生成K2FeO4:Na2FeO4+2KOH=K2FeO4+2NaOH
K2FeO4在水溶液中易水解:4FeO42-+10H2O ![]() 4Fe(OH)3+8OH-+3O2 , 在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用溶液(填序号)
4Fe(OH)3+8OH-+3O2 , 在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用溶液(填序号)
A.水 B.NH4Cl、异丙醇 C.Fe(NO3)3、异丙醇 D.CH3COONa、异丙醇
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com