
【题目】在日常生活中,为了达到更好的清洁效果,经常有人会将洁厕液(含有盐酸)与84消毒液混合使用,从而会发生引发中毒的事故。
(1)84消毒液的主要成分是次氯酸钠,写出次氯酸钠的电子式:。
(2)洁厕灵的主要成分是HCl。下列关于卤化氢的性质比较中错误的是
A.酸性:HF>HCl>HBr>HI
B.键能:H—F>H—Cl>H—Br>H—I
C.熔点:HF<HCl<HBr<HI
D.还原性:HF<HCl<HBr<HI
(3)常温下,0.1mol/L的NaClO溶液的pH=9.7,原因。常温下HClO的电离平衡常数为。洁厕液与84消毒液混合后会生成有毒的氯气。写出该反应的离子方程式。
(4)高铁酸钾是一种高效多功能水处理剂,工业上常采用NaClO氧化法生产,反应原理为:
①在碱性条件下,利用NaClO氧化硝酸铁,制得Na2FeO4 , 该反应的离子反应方程式为。
②Na2FeO4与KOH反应生成K2FeO4:Na2FeO4+2KOH=K2FeO4+2NaOH
K2FeO4在水溶液中易水解:4FeO42-+10H2O ![]() 4Fe(OH)3+8OH-+3O2 , 在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用溶液(填序号)
4Fe(OH)3+8OH-+3O2 , 在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用溶液(填序号)
A.水 B.NH4Cl、异丙醇 C.Fe(NO3)3、异丙醇 D.CH3COONa、异丙醇
【答案】
(1)![]()
(2)A,C
(3)ClO-+H2O ![]() HClO+OH-;10-6.4 ;ClO-+Cl-+2H+ =Cl2+H2O;
HClO+OH-;10-6.4 ;ClO-+Cl-+2H+ =Cl2+H2O;
(4)2Fe3++3ClO- +10OH- =2FeO42-+5H2O+3Cl- ;d
【解析】(1)次氯酸钠是离子化合物,氧原子和氯原子共用1对共用电子对,电子式为: ![]() ;
;
(2)A、F、Cl、Br、I的电负性依次减弱,电负性越大,酸性越弱,故其氢化物的酸性依次增强,A符合题意;
B、原子半径越大,共价键键长越大,键能越小,原子半径:F<Cl<Br<I,则共价键的键长:H-F<H-C1<H-Br<H-I,键能:H-F>H-Cl>H-Br>H-I,B不符合题意;
C、四种物质都是分子晶体,组成和结构相似,分子的相对分子质量越大,分子间作用力越大,则其熔沸点越高,但是HF中氢键熔点反常,比卤素的其他氢化物熔点高,所以熔点由低到高:HCl<HBr<HI<HF,C符合题意;
D、元素的非金属性越强,对应氢化物的还原性越弱,因为非金属性:F>Cl>Br>I,故还原性:HF<HCl<HBr<HI,D不符合题意;
(3)常温下,0.1mol/L的NaClO溶液的pH=9.7,溶液显碱性,次氯酸钠溶液中次氯酸根离子水解显碱性,反应的离子方程式为:ClO-+H2OHClO+OH- , 常温下,0.1mol/L的NaClO溶液的pH=9.7,ClO-+H2O ![]() HClO+OH- , Kh=
HClO+OH- , Kh= ![]() =
= ![]() ×
× ![]() =
= ![]() ,则Ka=
,则Ka= 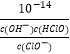 =
= ![]() =10-6.4 , 次氯酸钠有强氧化性,盐酸有强还原性,两者相遇发生氧化还原反应生成氯气,方程式为:NaClO+2HCl═NaCl+Cl2↑+H2O,离子方程式为:ClO-+Cl-+2H+=Cl2↑+H2O;
=10-6.4 , 次氯酸钠有强氧化性,盐酸有强还原性,两者相遇发生氧化还原反应生成氯气,方程式为:NaClO+2HCl═NaCl+Cl2↑+H2O,离子方程式为:ClO-+Cl-+2H+=Cl2↑+H2O;
(4)①在碱性条件下,利用NaClO氧化硝酸铁,制得Na2FeO4 , 该反应的离子反应方程式为2Fe3++3ClO-+10OH-=2FeO42-+5H2O+3Cl-;
②为抑制K2FeO4的水解,应在碱性条件下洗涤,可用CH3COONa,为防止K2FeO4的溶解,可用异丙醇洗涤;
故答案为:(1)![]() ;(2)AC;(3)次氯酸根离子水解溶液显碱性,ClO-+H2O HClO+OH- , 10-6.4 , ClO-+Cl-+2H+=Cl2↑+H2O;(4)2Fe3++3ClO-+10OH-=2FeO42-+5H2O+3Cl-;d
;(2)AC;(3)次氯酸根离子水解溶液显碱性,ClO-+H2O HClO+OH- , 10-6.4 , ClO-+Cl-+2H+=Cl2↑+H2O;(4)2Fe3++3ClO-+10OH-=2FeO42-+5H2O+3Cl-;d
(1)根据电子式的书写规则书写;
(2)A.根据元素周期律判断;
B.原子半径越大,共价键键长越大,键能越小;
C.分子的相对分子质量越大,分子间作用力越大,则其熔沸点越高;
D.元素的非金属性越强,对应氢化物的还原性越弱;
(3)根据水解规律分析;HClO的电离平衡常数![]() 进行计算;84消毒液的主要成分是NaClO;
进行计算;84消毒液的主要成分是NaClO;
(4)①由题干确定反应和生成物,结合氧化还原反应转移电子守恒进行配平;
②碱性条件,可抑制K2FeO4的水解。


科目:高中化学 来源: 题型:
【题目】天然同位素原子R的一个原子中共有96个微粒,其中36个微粒不带电,则R的质量数和中子数分别为( )
A.36、30B.66、30C.66、36D.60、30
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制240 mL 0.2 mol·L-1的KNO3溶液,需量取4 mol·L-1 KNO3溶液的体积为
A.25.0 mLB.12.5 mL
C.12.0 mLD.75.0 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“铝热反应”的化学方程式为2Al+Fe2O3![]() Al2O3+2Fe。某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
Al2O3+2Fe。某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
物质 | Al | Al2O3 | Fe | Fe2O3 |
熔点/℃ | 660 | 2 054 | 1 535 | 1 462 |
沸点/℃ | 2 467 | 2 980 | 2 750 | —— |
(1)该同学推测,铝热反应所得到的熔融物应是铁铝合金。这种推测有一定的道理,理由是________________________________________________________________________。
(2)根据已有知识找出一种验证产物中有Fe的最简单方法:_____________________。
(3)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是________,当观察到________时,说明熔融物中含有金属铝。
(4)实验室溶解该熔融物,最好选用下列试剂中的____(填字母),理由是__________。
A.浓硫酸 B.稀硫酸
C.稀硝酸 D.氢氧化钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一些治感冒的药物含有PPA成分,PPA对感冒有比较好的对症疗效,但也有较大的副作用,2000年11月,我国药监局紧急通知,停止使用含有PPA成分的感冒药,PPA是盐酸苯丙醇胺(pheng propanolamine的缩写),从其名称看,其有机成分的分子结构中肯定不含下列中的( )
A.﹣OH
B.﹣COOH
C.﹣C6H5
D.﹣NH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业生产中所用的α—Fe催化剂的成分是FeO、Fe2O3,当催化剂中Fe2+与Fe3+的物质的量之比为1:2时,其催化活性最高,此时混合物中铁的质量分数约为
A.70.0% B.77.8% C.72.4% D.75.0%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质的说法正确的是
A.硫酸钠溶液能导电,所以它是电解质B.电解质在熔融状态下都能导电
C.水溶液能导电的化合物不一定是电解质D.难溶物质肯定不是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA代表阿伏加德罗常数的值,下列说法正确的是
A. 常温常压下,1mol Al与足量HCl溶液反应失去的电子数为3NA
B. 标准状况下,11.2L H2O所含的分子数为0.5NA
C. 0.1molNa+所含的电子数为1.1NA
D. 通常状况下,NA 个CO2分子占有的体积为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从淡化海水中提取溴的流程如下图所示,下列有关说法错误的是( )
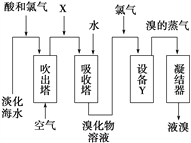
A. X为SO2气体,也可将SO2换成Na2SO3
B. 设备Y为蒸馏塔
C. 在提取溴的过程中一定有Br-被氧化
D. 工业上,每获得1 mol Br2,需要消耗Cl2的体积最多为44.8 L(标准状况)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com