
【题目】从淡化海水中提取溴的流程如下图所示,下列有关说法错误的是( )
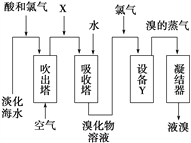
A. X为SO2气体,也可将SO2换成Na2SO3
B. 设备Y为蒸馏塔
C. 在提取溴的过程中一定有Br-被氧化
D. 工业上,每获得1 mol Br2,需要消耗Cl2的体积最多为44.8 L(标准状况)
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在日常生活中,为了达到更好的清洁效果,经常有人会将洁厕液(含有盐酸)与84消毒液混合使用,从而会发生引发中毒的事故。
(1)84消毒液的主要成分是次氯酸钠,写出次氯酸钠的电子式:。
(2)洁厕灵的主要成分是HCl。下列关于卤化氢的性质比较中错误的是
A.酸性:HF>HCl>HBr>HI
B.键能:H—F>H—Cl>H—Br>H—I
C.熔点:HF<HCl<HBr<HI
D.还原性:HF<HCl<HBr<HI
(3)常温下,0.1mol/L的NaClO溶液的pH=9.7,原因。常温下HClO的电离平衡常数为。洁厕液与84消毒液混合后会生成有毒的氯气。写出该反应的离子方程式。
(4)高铁酸钾是一种高效多功能水处理剂,工业上常采用NaClO氧化法生产,反应原理为:
①在碱性条件下,利用NaClO氧化硝酸铁,制得Na2FeO4 , 该反应的离子反应方程式为。
②Na2FeO4与KOH反应生成K2FeO4:Na2FeO4+2KOH=K2FeO4+2NaOH
K2FeO4在水溶液中易水解:4FeO42-+10H2O ![]() 4Fe(OH)3+8OH-+3O2 , 在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用溶液(填序号)
4Fe(OH)3+8OH-+3O2 , 在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用溶液(填序号)
A.水 B.NH4Cl、异丙醇 C.Fe(NO3)3、异丙醇 D.CH3COONa、异丙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验的说法不正确的是( )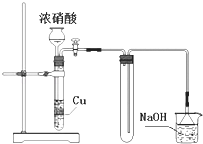
A.用广泛pH试纸测得0.051 molL﹣1 H2SO4溶液的pH=1
B.某气体制备装置如右图,该装置可减少污染性气体的泄漏,且有利于收集到空气含量较低的气体
C.在分液操作中,当试液分层后,打开旋塞,将下层液体放出,然后关闭旋塞,将上层液体从上口倒出
D.10mL溴水与5mL正己烷混合,在光照下振荡后静置,当试液分为上、下两层且几乎无色时,用玻璃棒蘸取浓氨水伸入液面上方,可观察到有白烟生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2O、NaOH、Na2CO3、Na2SO4可按某种标准划分为同一类物质,下列分类标准不正确的是 ①钠的化合物 ②能与硝酸反应的物质 ③钠盐 ④钠的含氧化合物
A. ①④ B. ③④
C. ②③ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是 ( )
A.任何物质的摩尔质量就等于它的相对原子质量或相对分子质量
B.摩尔是国际单位制中七个基本物理量之一
C.CO2的摩尔质量是44g
D.1.5molCH3COOH含有的H数目为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银铜合金广泛用于航空工业。从切割废料中回收银并制备铜化工产品的工艺如下: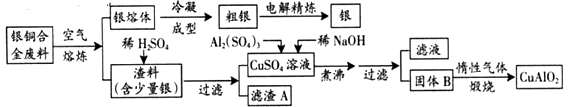
(注:Al(OH)3和Cu(OH)2开始分解的温度分别为450℃和80℃)
(1)固体混合物B的组成为;在生成固体B的过程中,需控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为。
(2)完成煅烧过程中一个反应的化学方程式:。
(3)若银铜合金中铜的质量分数为64%,理论上5.0kg废料中的铜可完全转化为CuAlO2 , 至少需要1.0mol·L-1的Al2(SO4)3溶液 L。
(4)某同学用FeCl3溶液吸收H2S,得到单质硫;过滤后,再以石墨为电极,在一定条件下电解滤液。
①FeCl3与H2S反应的离子方程式为。
②电解池中H+在阴极放电产生H2 , 阳极的电极反应为。
③综合分析实验II的两个反应,可知该实验有两个显著优点:
H2S的原子利用率100%;。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,测得纯水中c(H+)=2×10﹣7 mol/L,则此时c(OH﹣)为( )
A.0.5×10﹣7 mol/L
B.1×10﹣7 mol/L
C.2×10﹣7 mol/L
D.4×10﹣7 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数依次增大的A、B、C、D、E、F六种元素.其中A的基态原子有3个不同的能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E和C位于同一主族,F的原子序数为29.
(1)F原子基态的外围核外电子排布式为 .
(2)在A、B、C三种元素中,第一电离能由小到大的顺序是(用元素符号回答).
(3)元素B的简单气态氢化物的沸点(高于,低于)元素A的简单气态氢化物的沸点,其主要原因是 .
(4)由A、B、C形成的离子CAB﹣与AC2互为等电子体,则CAB﹣的结构式为 .
(5)在元素A与E所形成的常见化合物中,A原子轨道的杂化类型为 .
(6)由B、C、D三种元素形成的化合物晶体的晶胞如图所示,则该化合物的化学式为 . 
(7)FC在加热条件下容易转化为F2C,从原子结构的角度解释原因
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】安徽省具有丰富的铜矿资源,请回答下列有关铜及其化合物的问题,
(1)请写出基态Cu原子的外围电子排布式 . 焰火中的绿色是铜的焰色,基态铜原子在灼烧时外围电子发生了而变为激发态.
(2)新型农药松脂酸铜具有低残留的特点,图1是松脂酸铜的结构简式 
请分析1个松脂酸铜中π键的个数;加“*”碳原子的杂化方式为 .
(3)图2是某铜矿的晶胞图,请推算出此晶胞的化学式(以X表示某元素符号);与X等距离且最近的X原子个数为 .
(4)黄铜矿在冶炼的时候会产生副产品SO2 , SO2分子的几何构型 , 比较第一电离能:SO(填“>”或“<”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com