
����Ŀ����ͭ�Ͻ�㷺���ں��չ�ҵ�����и�����л��������Ʊ�ͭ������Ʒ�Ĺ������£�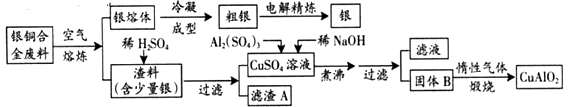
(ע��Al(OH)3��Cu(OH)2��ʼ�ֽ���¶ȷֱ�Ϊ450���80��)
��1����������B�����Ϊ�������ɹ���B�Ĺ����У������NaOH�ļ���������NaOH�����������������ķ�Ӧ�����ӷ���ʽΪ��
��2��������չ�����һ����Ӧ�Ļ�ѧ����ʽ����
��3������ͭ�Ͻ���ͭ����������Ϊ64%��������5��0kg�����е�ͭ����ȫת��ΪCuAlO2 �� ������Ҫ1��0mol��L-1��Al2(SO4)3��Һ L��
��4��ijͬѧ��FeCl3��Һ����H2S���õ��������˺�����ʯīΪ�缫����һ�������µ����Һ��
��FeCl3��H2S��Ӧ�����ӷ���ʽΪ��
�ڵ�����H+�������ŵ����H2 �� �����ĵ缫��ӦΪ��
���ۺϷ���ʵ��II��������Ӧ����֪��ʵ�������������ŵ㣺
H2S��ԭ��������100%����
���𰸡�
��1��CuO��Al(OH)3��Al(OH)3+OH-��AlO2-+2H2O
��2��4CuO+2Al2O3 ![]() 4CuAlO2+O2��
4CuAlO2+O2��
��3��25.0
��4��2Fe3+��H2S=2Fe2+��S����2H+��Fe2+��e��=Fe3+��FeCl3�õ�ѭ�����á�
����������1��δ���֮ǰ��Cu(OH)2��Al(OH)3 �� Al(OH)3��Cu(OH)2��ʼ�ֽ���¶ȷֱ�Ϊ450���80�棬��к�Cu(OH)2�ֽ��������ͭ����֪BΪAl(OH)3��CuO��������������������Ӧ��Al(OH)3+NaOH=NaAlO2+2H2O��
��2��BΪAl(OH)3��CuO����������ͼ��������յķ�Ӧ�Ļ�ѧ����ʽΪ��4CuO+2Al2O3 ![]() 4CuAlO2+O2����
4CuAlO2+O2����
��3���ɹ�ϵʽ��Cu��CuAlO2��n(CuAlO2)= ![]() =50��0mol����CuAlO2Ϊ50.0mol��
=50��0mol����CuAlO2Ϊ50.0mol��
�ɹ�ϵʽ��Al2(SO4)3��2CuAlO2��n(Al2(SO4)3)=n(CuAlO2)�� ![]() =25��0mol��������Ҫ���Ϊ
=25��0mol��������Ҫ���Ϊ ![]() =25.0L��
=25.0L��
��4����H2S����ǿ��ԭ�ԣ�Fe3+���н�ǿ�������ԣ����Խ�S2-������S���ʣ���������ԭ��Fe2+ �� ����H2S��������ʣ�����д���ӷ���ʽʱ��Ӧд�����ʽ����2Fe3++H2S�TS��+2Fe2++2H+��
�ڵ���Ȼ�����ʱ���������������ӵõ��ӵĻ�ԭ��Ӧ��2H++2e-�TH 2���������������ӷ���ʧ���ӵ�������Ӧ��Fe2+-e-=Fe3+�����Դ��ǣ�
��FeCl3�õ�ѭ�����ã�
���Դ��ǣ���1��Al(OH)3��CuO��Al(OH)3+OH-=AlO2-+2H2O����2��4CuO+2Al2O3 ![]() 4CuAlO2+O2������3��25.0����4��2Fe3++H2S�TS��+2Fe2++2H+��Fe2+-e-=Fe3+��FeCl3�õ�ѭ������
4CuAlO2+O2������3��25.0����4��2Fe3++H2S�TS��+2Fe2++2H+��Fe2+-e-=Fe3+��FeCl3�õ�ѭ������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ϳɰ���ҵ���������õĦ���Fe�����ijɷ���FeO��Fe2O3����������Fe2+��Fe3+�����ʵ���֮��Ϊ1:2ʱ�����������ߣ���ʱ�������������������ԼΪ
A��70.0% B��77.8% C��72.4% D��75.0%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ��10mL 0.1molL��1 ��һԪ��HA��Һ����ˮ��Լ��0.1%�������루ÿ1000��HAֻ��1��HA���룩��������������ȷ���ǣ� ��
A.����Һ��pHԼ��4
B.HAһ����һ������
C.ǡ���к�ʱ����NaOH�����ʵ�����10��6mol
D.������Mg��ȫ��Ӧ���ɱ�״������������������11.2 mL
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʶ�ˮ�ĵ������������õ��ǣ� ��
A.HCl
B.NH4Cl
C.CH3COONa
D.NaCl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ӵ�����ˮ����ȡ�����������ͼ��ʾ�������й�˵���������(����)
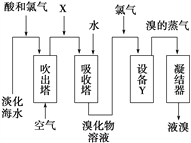
A. XΪSO2���壬Ҳ�ɽ�SO2����Na2SO3
B. �豸YΪ������
C. ����ȡ��Ĺ�����һ����Br��������
D. ��ҵ�ϣ�ÿ���1 mol Br2����Ҫ����Cl2��������Ϊ44.8 L(��״��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ú��һ�ֳ��õ�ȼ�ϡ�����úȼ�ղ����ķ����к���SO2��NO2��NO�ȶ����к�������̳�����Ի��������Ⱦ�������Ҫ��ú���мӹ�����ȼ�գ��������������ŷš�
(1)��úֱ�ӽ���ȼ�տ��ܻ��γ����������ꡣ
��д���й�����ת��Ϊ����Ļ�ѧ����ʽ_________________��
�������Ƕ���������������ۣ�������ȷ����________(��������)��
a��ɱ��ˮ�еĸ��������������ʳ����Դ���ƻ�ˮ����̬ϵͳ
b���Ե��ߡ����졢���������ݵȾ������������
c���ƻ������㣬���³����ն�
d�������������еĿ����ʷ�������ת��Ϊ�����Σ���ֲ���ṩ����
(2)��ͼ�Ƕ�úȼ�ղ����ķ������г����������Ļ�������ʾ��ͼ����д���ڷ��������γɸ�����Ĺ���������������Ҫ��ѧ��Ӧ�Ļ�ѧ����ʽ_______________��
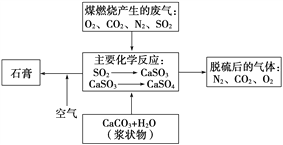
(3)�����Ժ��ڷ����к����������ӵIJ���������(д��������)________�����Ի����ĸ���Ӱ����___________________________________________��
(4)���������������Ƿ���SO2�ļ�����________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧʽ���ܱ�ʾ���ʵ���ɣ����ܱ�ʾ���ʷ���ʽ���ǣ�������
A.NH4NO3B.SiO2C.H2OD.Cu
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Fe2+��Fe3+��O22����CN����F�����л����ӵ��γɵĻ�������й㷺��Ӧ�ã� 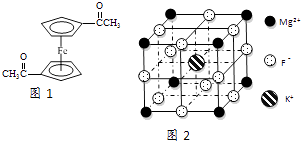
��1��C��N��Oԭ�ӵĵ�һ�������ɴ�С��˳����
��2��Fe2+��̬��������Ų�ʽΪ ��
��3����������ï���dz������Ϳ��������ṹ��ͼ1��ʾ����������̼ԭ�ӵ��ӻ���ʽ�� ��
��4�������K3Fe��CN��6�����ڵ��Ӵ������������������廥Ϊ�ȵ������һ�ַ��ӵĻ�ѧʽΪ �� ��֪��CN��2��ֱ���ͷ��ӣ������жԳ��ԣ���CN��2�Цм��ͦҼ��ĸ�����Ϊ ��
��5��F����������Fe3+�γ�[FeF6]3�� �� ��������Mg2+��K+�γ�һ��������ϵ�����Ӿ��壬�˾���Ӧ���ڼ������ṹ��ͼ2��ʾ���þ���Ļ�ѧʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Һ��ȼ�ϵ�����������ȼ�ϵ�ؾ������С���ŵ㡣һ����Һ̬�£�N2H4��Ϊȼ�ϵĵ��װ����ͼ��ʾ���õ���ÿ����е�������Ϊ��������KOH��Һ��Ϊ�������Һ�����й��ڸõ�ص�������ȷ����
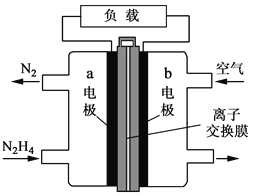
A. b������������Ӧ
B. a���ķ�Ӧʽ��N2H4��4OH����4e����N2����4H2O
C. �ŵ�ʱ��������a��������������b��
D. ���е����ӽ���Ĥ��ѡ�������ӽ���Ĥ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com