
【题目】25℃时,10mL 0.1molL﹣1 的一元酸HA溶液,在水中约有0.1%发生电离(每1000个HA只有1个HA电离),下列叙述不正确的是( )
A.该溶液的pH约是4
B.HA一定是一种弱酸
C.恰好中和时消耗NaOH的物质的量是10﹣6mol
D.与足量Mg完全反应生成标准状况下气体的体积可能是11.2 mL
【答案】C
【解析】解:A.c(H+)=0.1molL﹣1×0.1%=10﹣4mol/L,则该溶液的pH=﹣lg10﹣4=4,故A正确; B.一元酸HA在水中约有0.1%发生电离,说明HA为弱酸,存在电离平衡,故B正确;
C.10mL 0.1molL﹣1的一元酸HA溶液中含有HA的物质的量为;0.1mol/L×0.01L=0.001mol,则恰好中和时消耗NaOH的物质的量为0.001mol,故C错误;
D.根据H原子守恒可知0.001molHA与足量Mg完全反应生成氢气的物质的量为:0.001mol× ![]() =0.0005mol,标准状况下0.0005mol氢气的体积约为:22.4L/mol×0.0005mol=0.0112L=11.2mL,故D正确;
=0.0005mol,标准状况下0.0005mol氢气的体积约为:22.4L/mol×0.0005mol=0.0112L=11.2mL,故D正确;
故选C.
【考点精析】关于本题考查的弱电解质在水溶液中的电离平衡,需要了解当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理才能得出正确答案.


科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值.下列说法正确的是( )
A.常温常压下,28g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA
B.室温下,1LpH=13的Ba(OH)2溶液中含有的Ba2+个数为0.1NA
C.1molFeI2与足量氯气反应时转移的电子数为2NA
D.78g苯含有C=C键的数目为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】冬青油又叫水杨酸甲酯,是一种重要的有机合成原料。某化学小组用水杨酸( 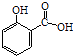 )和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率。
)和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率。
实验步骤:
Ⅰ.如图,在三颈烧瓶中加入13.8g (0.1mol)水杨酸和24 g(30 mL,0.75 mol)甲醇,向混合物中加入约10 mL甲苯(甲苯与水形成的共沸物,沸点为85℃,该实验中加入甲苯,易将水蒸出),再小心地加入5 mL浓硫酸,摇动混匀,加入1~2粒沸石,组装好实验装置,在85~95℃下恒温加热反应1.5小时: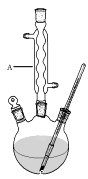
Ⅱ.待装置冷却后,分离出甲醇,然后转移至分液漏斗,依次用少量水、5%NaHCO3溶液和水洗涤;分出的产物加入少量无水MgSO4固体,过滤得到粗酯;
Ⅲ.将粗酯进行蒸馏,收集221℃~224℃的馏分,得水杨酸甲酯9.12g。
常用物理常数:
名称 | 分子量 | 颜色状态 | 相对密度 | 熔点(℃) | 沸点(℃) |
水杨酸甲酯 | 152 | 无色液体 | 1.18 | -8.6 | 224 |
水杨酸 | 138 | 白色晶体 | 1.44 | 158 | 210 |
甲醇 | 32 | 无色液体 | 0.792 | -97 | 64.7 |
请根据以上信息回答下列问题:
(1)仪器A的名称是 , 加入沸石的作用是。若加热后发现未加沸石,应采取的正确方法是。
(2)制备水杨酸甲酯时,最合适的加热方法是。
(3)实验中加入甲苯对合成水杨酸甲酯的作用是。
(4)反应结束后,分离出甲醇采用的方法是。
(5)实验中加入无水硫酸镁的作用是。本实验的产率为(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验误差分析中,不正确的是( )
A.用湿润的pH试纸测稀碱液的pH值,测定值偏小
B.用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小
C.滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小
D.测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度值偏低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验的说法不正确的是( )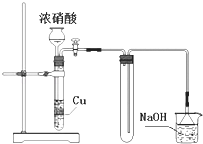
A.用广泛pH试纸测得0.051 molL﹣1 H2SO4溶液的pH=1
B.某气体制备装置如右图,该装置可减少污染性气体的泄漏,且有利于收集到空气含量较低的气体
C.在分液操作中,当试液分层后,打开旋塞,将下层液体放出,然后关闭旋塞,将上层液体从上口倒出
D.10mL溴水与5mL正己烷混合,在光照下振荡后静置,当试液分为上、下两层且几乎无色时,用玻璃棒蘸取浓氨水伸入液面上方,可观察到有白烟生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,正确的是
A. 稀硫酸滴在铜片上:Cu + 2H+ = Cu2+ + H2O
B. 氧化镁与稀盐酸混合:MgO +2H+ = Mg2+ + H2O
C. 铜片插入硝酸银溶液中:Cu +Ag+ = Cu2+ + Ag
D. 稀硝酸滴在石灰石上:CaCO3+2H+ = Ca2+ + H2 CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2O、NaOH、Na2CO3、Na2SO4可按某种标准划分为同一类物质,下列分类标准不正确的是 ①钠的化合物 ②能与硝酸反应的物质 ③钠盐 ④钠的含氧化合物
A. ①④ B. ③④
C. ②③ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银铜合金广泛用于航空工业。从切割废料中回收银并制备铜化工产品的工艺如下: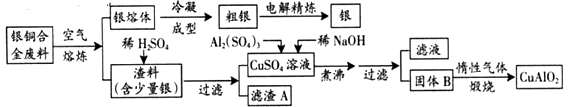
(注:Al(OH)3和Cu(OH)2开始分解的温度分别为450℃和80℃)
(1)固体混合物B的组成为;在生成固体B的过程中,需控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为。
(2)完成煅烧过程中一个反应的化学方程式:。
(3)若银铜合金中铜的质量分数为64%,理论上5.0kg废料中的铜可完全转化为CuAlO2 , 至少需要1.0mol·L-1的Al2(SO4)3溶液 L。
(4)某同学用FeCl3溶液吸收H2S,得到单质硫;过滤后,再以石墨为电极,在一定条件下电解滤液。
①FeCl3与H2S反应的离子方程式为。
②电解池中H+在阴极放电产生H2 , 阳极的电极反应为。
③综合分析实验II的两个反应,可知该实验有两个显著优点:
H2S的原子利用率100%;。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)为了检验和除去下表中的各种杂质(括号里的为杂质),请从①中选出适当的检验试剂,从②中选出适当的除杂试剂,将所选的答案用字母填入相应的空格内。
物质 | 检验试剂 | 除杂试剂 |
(Ⅰ)甲烷(乙烯) | ________。 | ________。 |
(Ⅱ)酒精(水) | ________。 | ________。 |
①检验试剂:
A.无水硫酸铜 B.酸性高锰酸钾溶液
C.水 D.氢氧化钠溶液
②除杂试剂:
a.无水硫酸铜 b.乙酸
c.新制的生石灰 d.溴水
除杂时,乙烯发生反应的化学方程式为____________________。
(2)如图,在左试管中先加入2 mL 95%的乙醇,并在摇动下缓缓加入3 mL浓硫酸,再加入2 mL乙酸,充分摇匀。按图连接好装置,用酒精灯对左试管小火加热3~5 min后,改用大火加热,当观察到右试管中有明显现象时停止实验。
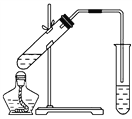
试回答:
在右试管中通常加入________溶液,实验生成的乙酸乙酯,其密度比水________,是有特殊香味的液体。分离右试管中所得乙酸乙酯的操作为(只填名称)________。反应中加入浓硫酸的作用是_____________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com