
【题目】下列有关实验误差分析中,不正确的是( )
A.用湿润的pH试纸测稀碱液的pH值,测定值偏小
B.用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小
C.滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小
D.测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度值偏低
科目:高中化学 来源: 题型:
【题目】天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂.关于维生素P的叙述错误的是( ) 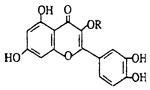
A.可溶于有机溶剂
B.分子中有三个苯环
C.1mol维生素P可以和6molBr2反应
D.1mol维生素P可以和4molNaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业生产中所用的α—Fe催化剂的成分是FeO、Fe2O3,当催化剂中Fe2+与Fe3+的物质的量之比为1:2时,其催化活性最高,此时混合物中铁的质量分数约为
A.70.0% B.77.8% C.72.4% D.75.0%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生配制100mL 1mol/L的硫酸溶液,进行下列操作,然后对溶液浓度作精确测定,发现真实浓度小于1mol/L。他的下列操作中使浓度偏低的原因是 ( )
①用量筒取浓硫酸时,俯视读数;②量筒中浓硫酸全部转移到烧杯中稀释,再转移到100mL容量瓶中,烧杯未洗涤;③用玻璃棒引流将烧杯中溶液转移至容量瓶中,有溶液流到了容量瓶外面;④用胶头滴管加蒸馏水时,不是逐滴加入,因而使液面超过了刻度线,他立即用滴管吸去多余的水,使溶液凹面刚好和刻度线相切。
A. ②③④ B. ③④
C. ①②③ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA代表阿伏加德罗常数的值,下列说法正确的是
A. 常温常压下,1mol Al与足量HCl溶液反应失去的电子数为3NA
B. 标准状况下,11.2L H2O所含的分子数为0.5NA
C. 0.1molNa+所含的电子数为1.1NA
D. 通常状况下,NA 个CO2分子占有的体积为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,10mL 0.1molL﹣1 的一元酸HA溶液,在水中约有0.1%发生电离(每1000个HA只有1个HA电离),下列叙述不正确的是( )
A.该溶液的pH约是4
B.HA一定是一种弱酸
C.恰好中和时消耗NaOH的物质的量是10﹣6mol
D.与足量Mg完全反应生成标准状况下气体的体积可能是11.2 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe2+、Fe3+与O22﹣、CN﹣、F﹣、有机分子等形成的化合物具有广泛的应用. 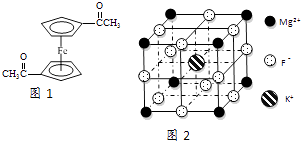
(1)C、N、O原子的第一电离能由大到小的顺序是
(2)Fe2+基态核外电子排布式为 .
(3)乙酰基二茂铁是常用汽油抗震剂,其结构如图1所示.此物质中碳原子的杂化方式是 .
(4)配合物K3Fe(CN)6可用于电子传感器的制作.与配体互为等电子体的一种分子的化学式为 . 已知(CN)2是直线型分子,并具有对称性,则(CN)2中π键和σ键的个数比为 .
(5)F﹣不仅可与Fe3+形成[FeF6]3﹣ , 还可以与Mg2+、K+形成一种立方晶系的离子晶体,此晶体应用于激光领域,结构如图2所示.该晶体的化学式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com