
【题目】用NA代表阿伏加德罗常数的值,下列说法正确的是
A. 常温常压下,1mol Al与足量HCl溶液反应失去的电子数为3NA
B. 标准状况下,11.2L H2O所含的分子数为0.5NA
C. 0.1molNa+所含的电子数为1.1NA
D. 通常状况下,NA 个CO2分子占有的体积为22.4L
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在日常生活中,为了达到更好的清洁效果,经常有人会将洁厕液(含有盐酸)与84消毒液混合使用,从而会发生引发中毒的事故。
(1)84消毒液的主要成分是次氯酸钠,写出次氯酸钠的电子式:。
(2)洁厕灵的主要成分是HCl。下列关于卤化氢的性质比较中错误的是
A.酸性:HF>HCl>HBr>HI
B.键能:H—F>H—Cl>H—Br>H—I
C.熔点:HF<HCl<HBr<HI
D.还原性:HF<HCl<HBr<HI
(3)常温下,0.1mol/L的NaClO溶液的pH=9.7,原因。常温下HClO的电离平衡常数为。洁厕液与84消毒液混合后会生成有毒的氯气。写出该反应的离子方程式。
(4)高铁酸钾是一种高效多功能水处理剂,工业上常采用NaClO氧化法生产,反应原理为:
①在碱性条件下,利用NaClO氧化硝酸铁,制得Na2FeO4 , 该反应的离子反应方程式为。
②Na2FeO4与KOH反应生成K2FeO4:Na2FeO4+2KOH=K2FeO4+2NaOH
K2FeO4在水溶液中易水解:4FeO42-+10H2O ![]() 4Fe(OH)3+8OH-+3O2 , 在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用溶液(填序号)
4Fe(OH)3+8OH-+3O2 , 在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用溶液(填序号)
A.水 B.NH4Cl、异丙醇 C.Fe(NO3)3、异丙醇 D.CH3COONa、异丙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】冬青油又叫水杨酸甲酯,是一种重要的有机合成原料。某化学小组用水杨酸( 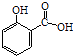 )和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率。
)和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率。
实验步骤:
Ⅰ.如图,在三颈烧瓶中加入13.8g (0.1mol)水杨酸和24 g(30 mL,0.75 mol)甲醇,向混合物中加入约10 mL甲苯(甲苯与水形成的共沸物,沸点为85℃,该实验中加入甲苯,易将水蒸出),再小心地加入5 mL浓硫酸,摇动混匀,加入1~2粒沸石,组装好实验装置,在85~95℃下恒温加热反应1.5小时: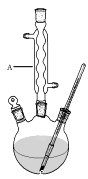
Ⅱ.待装置冷却后,分离出甲醇,然后转移至分液漏斗,依次用少量水、5%NaHCO3溶液和水洗涤;分出的产物加入少量无水MgSO4固体,过滤得到粗酯;
Ⅲ.将粗酯进行蒸馏,收集221℃~224℃的馏分,得水杨酸甲酯9.12g。
常用物理常数:
名称 | 分子量 | 颜色状态 | 相对密度 | 熔点(℃) | 沸点(℃) |
水杨酸甲酯 | 152 | 无色液体 | 1.18 | -8.6 | 224 |
水杨酸 | 138 | 白色晶体 | 1.44 | 158 | 210 |
甲醇 | 32 | 无色液体 | 0.792 | -97 | 64.7 |
请根据以上信息回答下列问题:
(1)仪器A的名称是 , 加入沸石的作用是。若加热后发现未加沸石,应采取的正确方法是。
(2)制备水杨酸甲酯时,最合适的加热方法是。
(3)实验中加入甲苯对合成水杨酸甲酯的作用是。
(4)反应结束后,分离出甲醇采用的方法是。
(5)实验中加入无水硫酸镁的作用是。本实验的产率为(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E五种元素,它们的质子数依次增多。
①A的核电荷数大于2,可形成氢化物H2A,该氢化物在常温下是液体;
②A和B两元素可形成B2A3化合物,该化合物既能溶于强酸,又能溶于强碱;
③C+比B3+多8个电子;
④C与D元素可以形成化合物CD;
⑤CD的溶液中通入氯气后加淀粉溶液显蓝色;
⑥在周期表中E处于C的下两个周期,E单质可与冷水反应生成氢气,反应时E的单质与生成的氢气的物质的量之比为2∶1。试回答:
(1)B是________(写元素符号,下同),E是________。
(2)B的离子结构示意图:________,D的单质分子的电子式:________,C元素最高价氧化物对应的水化物的电子式:________。
(3)用电子式表示H2A形成过程:_____________________。
(4)写出CD的溶液中通入氯气的离子方程式:__________________________。
(5)比较B、C、E三种元素形成的简单离子氧化性的强弱(B、C、E离子用实际离子符号表示):____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验误差分析中,不正确的是( )
A.用湿润的pH试纸测稀碱液的pH值,测定值偏小
B.用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小
C.滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小
D.测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度值偏低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验的说法不正确的是( )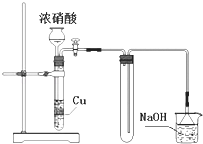
A.用广泛pH试纸测得0.051 molL﹣1 H2SO4溶液的pH=1
B.某气体制备装置如右图,该装置可减少污染性气体的泄漏,且有利于收集到空气含量较低的气体
C.在分液操作中,当试液分层后,打开旋塞,将下层液体放出,然后关闭旋塞,将上层液体从上口倒出
D.10mL溴水与5mL正己烷混合,在光照下振荡后静置,当试液分为上、下两层且几乎无色时,用玻璃棒蘸取浓氨水伸入液面上方,可观察到有白烟生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2O、NaOH、Na2CO3、Na2SO4可按某种标准划分为同一类物质,下列分类标准不正确的是 ①钠的化合物 ②能与硝酸反应的物质 ③钠盐 ④钠的含氧化合物
A. ①④ B. ③④
C. ②③ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数依次增大的A、B、C、D、E、F六种元素.其中A的基态原子有3个不同的能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E和C位于同一主族,F的原子序数为29.
(1)F原子基态的外围核外电子排布式为 .
(2)在A、B、C三种元素中,第一电离能由小到大的顺序是(用元素符号回答).
(3)元素B的简单气态氢化物的沸点(高于,低于)元素A的简单气态氢化物的沸点,其主要原因是 .
(4)由A、B、C形成的离子CAB﹣与AC2互为等电子体,则CAB﹣的结构式为 .
(5)在元素A与E所形成的常见化合物中,A原子轨道的杂化类型为 .
(6)由B、C、D三种元素形成的化合物晶体的晶胞如图所示,则该化合物的化学式为 . 
(7)FC在加热条件下容易转化为F2C,从原子结构的角度解释原因
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com