
����Ŀ��ԭ���������������A��B��C��D��E��F����Ԫ�أ�����A�Ļ�̬ԭ����3����ͬ���ܼ������ܼ��еĵ�������ȣ�C�Ļ�̬ԭ��2p�ܼ��ϵ�δ�ɶԵ�������Aԭ�ӵ���ͬ��DΪ������������ԭ�Ӱ뾶��������Ԫ�أ�E��Cλ��ͬһ���壬F��ԭ������Ϊ29��
��1��Fԭ�ӻ�̬����Χ��������Ų�ʽΪ ��
��2����A��B��C����Ԫ���У���һ��������С�����˳��������Ԫ�ط��Żش𣩣�
��3��Ԫ��B�ļ���̬�⻯��ķе������ڣ����ڣ�Ԫ��A�ļ���̬�⻯��ķе㣬����Ҫԭ���� ��
��4����A��B��C�γɵ�����CAB����AC2��Ϊ�ȵ����壬��CAB���ĽṹʽΪ ��
��5����Ԫ��A��E���γɵij����������У�Aԭ�ӹ�����ӻ�����Ϊ ��
��6����B��C��D����Ԫ���γɵĻ����ᄃ��ľ�����ͼ��ʾ����û�����Ļ�ѧʽΪ �� 
��7��FC�ڼ�������������ת��ΪF2C����ԭ�ӽṹ�ĽǶȽ���ԭ��
���𰸡�
��1��1s22s22p63s23p63d104s1��[Ar]3d104s1
��2��N��O��C
��3�����ڣ�B���⻯�����֮��������
��4��[N=C=O]��
��5��sp
��6��NaNO2
��7��Cu+��Χ����3d10���ȫ���ȶ���Cu2+��Χ����3d9������ӷ�ȫ���Ͱ���״̬���ȶ�
���������⣺ԭ���������������A��B��C��D��E��F����Ԫ�أ�A�Ļ�̬ԭ����3����ͬ���ܼ������ܼ��еĵ�������ȣ���A��CԪ�أ�C�Ļ�̬ԭ��2p�ܼ��ϵ�δ�ɶԵ�������Aԭ�ӵ���ͬ��Cԭ����������A����CΪOԪ�أ�Bԭ����������A��С��C����B��NԪ�أ�E��Cλ��ͬһ���壬��Eԭ������С��25����C��SԪ�أ�DΪ������������ԭ�Ӱ뾶��������Ԫ�أ�ԭ������С��S����D��NaԪ�أ�F��ԭ������Ϊ29��ΪCuԪ�أ���1��F��CuԪ�أ���ԭ�Ӻ�����29�����ӣ����ݹ���ԭ��֪CuԪ�ػ�̬ԭ�ӵĺ�������Ų�ʽΪ1s22s22p63s23p63d104s1��[Ar]3d104s1 �� ���Դ��ǣ�1s22s22p63s23p63d104s1��[Ar]3d104s1����2��A��B��C�ֱ���C��N��OԪ�أ�ͬһ����Ԫ�أ�Ԫ�ص�һ����������ԭ��������������������ƣ�����IIA�塢��VA��Ԫ�ص�һ�����ܴ���������Ԫ�أ����Ե����ܴ�С����˳����N��O��C�����Դ��ǣ�N��O��C����3������������⻯���۵�ϸߣ����������к�������������в���������������۷е���ڼ��飬���Դ��ǣ����ڣ�B���⻯�����֮������������4���ȵ�����ԭ�Ӹ�����ȡ��۵�������ȣ���C��N��O�γɵ�����OCN����CO2��Ϊ�ȵ����壬���ݶ�����̼�ṹʽ֪OCN���Ľṹ��ʽΪ[N=C=O]�� �� ���Դ��ǣ�[N=C=O]������5����Ԫ��C��S���γɵij���������CS2�У�����̼����������ԭ�Ӽ۲���ӶԸ�����2�Ҳ����µ��Ӷԣ�����Cԭ�Ӳ���sp�ӻ������Դ��ǣ�sp����6����N��O��Na����Ԫ���γɵĻ����ᄃ��ľ�����ͼ��ʾ���þ�����Nԭ�Ӹ���=1+8�� ![]() =2��Oԭ�Ӹ���=2+16��
=2��Oԭ�Ӹ���=2+16�� ![]() =4��Naԭ�Ӹ���=8��
=4��Naԭ�Ӹ���=8�� ![]() =2�����Ըþ�����Na��N��Oԭ�Ӹ���֮��=2��2��4=1��1��2����ѧʽΪNaNO2 �� ���Դ��ǣ�NaNO2����7����ԭ���е��Ӳ�ȫ����������ȫ��Ϊ�ȶ�״̬��Cu+��Χ����3d10���ȫ���ȶ���Cu2+��Χ����3d9������ӷ�ȫ���Ͱ���״̬���ȶ������Դ��ǣ�Cu+��Χ����3d10���ȫ���ȶ���Cu2+��Χ����3d9������ӷ�ȫ���Ͱ���״̬���ȶ���
=2�����Ըþ�����Na��N��Oԭ�Ӹ���֮��=2��2��4=1��1��2����ѧʽΪNaNO2 �� ���Դ��ǣ�NaNO2����7����ԭ���е��Ӳ�ȫ����������ȫ��Ϊ�ȶ�״̬��Cu+��Χ����3d10���ȫ���ȶ���Cu2+��Χ����3d9������ӷ�ȫ���Ͱ���״̬���ȶ������Դ��ǣ�Cu+��Χ����3d10���ȫ���ȶ���Cu2+��Χ����3d9������ӷ�ȫ���Ͱ���״̬���ȶ���


 �����ҵ��ٿ���������������ϵ�д�
�����ҵ��ٿ���������������ϵ�д� �»����ܶ�Ա��ϵ�д�
�»����ܶ�Ա��ϵ�д� ����ͼ����ּ��������ҵ֣�ݴ�ѧ������ϵ�д�
����ͼ����ּ��������ҵ֣�ݴ�ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA���������ӵ�������ֵ������˵����ȷ����
A. ���³�ѹ�£�1mol Al������HCl��Һ��Ӧʧȥ�ĵ�����Ϊ3NA
B. ��״���£�11.2L H2O�����ķ�����Ϊ0.5NA
C. 0.1molNa+�����ĵ�����Ϊ1.1NA
D. ͨ��״���£�NA ��CO2����ռ�е����Ϊ22.4L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ӵ�����ˮ����ȡ�����������ͼ��ʾ�������й�˵���������(����)
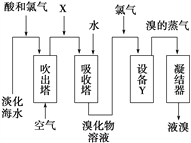
A. XΪSO2���壬Ҳ�ɽ�SO2����Na2SO3
B. �豸YΪ������
C. ����ȡ��Ĺ�����һ����Br��������
D. ��ҵ�ϣ�ÿ���1 mol Br2����Ҫ����Cl2��������Ϊ44.8 L(��״��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧʽ���ܱ�ʾ���ʵ���ɣ����ܱ�ʾ���ʷ���ʽ���ǣ�������
A.NH4NO3B.SiO2C.H2OD.Cu
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�����������ʵ��ע�������У���Ҫ�dz���ʵ�鰲ȫ���ǵ���
A.����ʱ������������©���ڽ���B.��ȼ��������鴿
C.ʹ�÷�Һ©��ǰҪ�����Ƿ�©ҺD.��ͷ�ιܲ��ܽ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Fe2+��Fe3+��O22����CN����F�����л����ӵ��γɵĻ�������й㷺��Ӧ�ã� 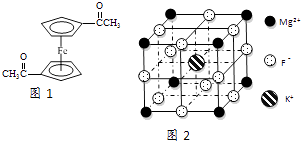
��1��C��N��Oԭ�ӵĵ�һ�������ɴ�С��˳����
��2��Fe2+��̬��������Ų�ʽΪ ��
��3����������ï���dz������Ϳ��������ṹ��ͼ1��ʾ����������̼ԭ�ӵ��ӻ���ʽ�� ��
��4�������K3Fe��CN��6�����ڵ��Ӵ������������������廥Ϊ�ȵ������һ�ַ��ӵĻ�ѧʽΪ �� ��֪��CN��2��ֱ���ͷ��ӣ������жԳ��ԣ���CN��2�Цм��ͦҼ��ĸ�����Ϊ ��
��5��F����������Fe3+�γ�[FeF6]3�� �� ��������Mg2+��K+�γ�һ��������ϵ�����Ӿ��壬�˾���Ӧ���ڼ������ṹ��ͼ2��ʾ���þ���Ļ�ѧʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���縡ѡ���۷��ǹ�ҵ�ϲ��õ�һ����ˮ������������ͼ�ǵ����ˮ��ʵ��װ��ʾ��ͼ��ʵ������ˮ����Ҫ���пɱ�����������������磩�������й��ƶ����Բ��������ǣ�������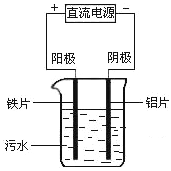
A.�����ĵ缫��ӦʽΪ��O2+4e-+2H2O=4OH-
B.ͨ��������ձ��ڲ������������������Fe��OH��3
C.ͨ������л�������ݣ������������ˮ���γɸ�����ȥ
D.���ʵ������ˮ�����Բ������ɼ�������Na2SO4��������ǿ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������У���Ϊͬ���칹����ǣ� ��
A.ʯī����ϩ
B.H2O��H2O2
C.1H �� 2H
D.�Ҵ��Ͷ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б仯һ�����ڻ�ѧ�仯���ǣ� �� �ٵ���ڱ�ը�ۻ���������SO2ʹƷ����Һ��ɫ����ˮ����ͭ�ɰױ�����ҵ��O2�߰���ת��Ϊ���� �����Ũ�����Ƣ�16O��18O����ת����
A.�ڢۢܢߢ��
B.�ۢܢݢߢ�
C.�ڢۢޢߢ�
D.�ܢݢޢ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com