
【题目】煤是一种常用的燃料。由于煤燃烧产生的废气中含有SO2、NO2和NO等多种有害气体和烟尘,会对环境造成污染,因此需要对煤进行加工后再燃烧,或将废气净化后再排放。
(1)将煤直接进行燃烧可能会形成硝酸型酸雨。
①写出有关物质转化为硝酸的化学方程式_________________。
②以下是对硝酸型酸雨的评价,其中正确的是________(用序号填空)。
a.杀死水中的浮游生物,减少鱼类食物来源,破坏水生生态系统
b.对电线、铁轨、桥梁、房屋等均会造成严重损害
c.破坏臭氧层,导致臭氧空洞
d.硝酸与土壤中的矿物质发生作用转化为硝酸盐,给植物提供氮肥
(2)如图是对煤燃烧产生的废气进行常温脱硫处理的基本流程示意图,试写出在废气脱硫并形成副产物的过程中所发生的主要化学反应的化学方程式_______________。
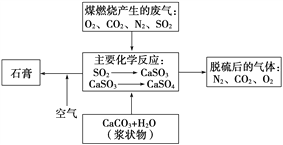
(3)脱硫以后,在废气中含量明显增加的不良气体是(写物质名称)________,它对环境的负面影响是___________________________________________。
(4)检验脱硫后废气中是否含有SO2的简单方法是________________。
【答案】 2NO+O2===2NO2,3NO2+H2O===2HNO3+NO abd CaCO3+SO2===CaSO3+CO2,2CaSO3+O2![]() 2CaSO4,CaSO4+2H2O===CaSO4·2H2O 二氧化碳 使温室效应加剧,导致气候变暖 将气体通入品红溶液,观察品红溶液是否褪色,若品红溶液褪色说明废气中还含有SO2;若品红溶液不褪色,说明废气中不含SO2
2CaSO4,CaSO4+2H2O===CaSO4·2H2O 二氧化碳 使温室效应加剧,导致气候变暖 将气体通入品红溶液,观察品红溶液是否褪色,若品红溶液褪色说明废气中还含有SO2;若品红溶液不褪色,说明废气中不含SO2
【解析】(1)①由于煤燃烧产生的废气含有SO2、NO2和NO等多种有害气体,硝酸型酸雨的形成过程是NO被O2氧化为二氧化氮,二氧化氮溶于水生成硝酸;2NO+O2=2NO2、3NO2+H2O=2HNO3+NO;②a:硝酸是强酸,具有强氧化性,能杀死水中的浮游生物,减少鱼类食物的来源,破坏水生生态系统,a正确;b:硝酸具有酸性,电线,铁轨,桥梁,含有金属铁等,它们能和硝酸反应,房屋也含有金属等,它们也能和硝酸反应,b正确;c:导致臭氧层空洞的是氟氯烃,不是硝酸,c错误;d:硝酸中含有氮元素,硝酸与土壤中的矿物质发生作用转化为硝酸盐,可向植物提供氮肥,d正确;答案选abd;(2碳酸钙与二氧化硫反应生成亚硫酸钙,亚硫酸钙不稳定易被氧化为硫酸钙,硫酸钙吸水变为石膏,因此废气脱硫并形成副产物的过程中所发生的主要化学反应的化学方程式为CaCO3+SO2===CaSO3+CO2,2CaSO3+O2![]() 2CaSO4,CaSO4+2H2O===CaSO4·2H2O;(3)根据以上分析可知反应中生成CO2,CO2会导致温室效应,导致气候变暖;(4)二氧化硫使品红溶液褪色,因此检验脱硫后废气中是否含有SO2的简单方法是将气体通入品红溶液,若品红溶液褪色说明废气中还含有SO2;若品红溶液不褪色,说明废气中不含SO2。
2CaSO4,CaSO4+2H2O===CaSO4·2H2O;(3)根据以上分析可知反应中生成CO2,CO2会导致温室效应,导致气候变暖;(4)二氧化硫使品红溶液褪色,因此检验脱硫后废气中是否含有SO2的简单方法是将气体通入品红溶液,若品红溶液褪色说明废气中还含有SO2;若品红溶液不褪色,说明废气中不含SO2。


科目:高中化学 来源: 题型:
【题目】为测定某有机物A的结构,进行如下实验. [分子式的确定]
(1)将有机物A置于氧气流中充分燃烧,实验测得:生成9.0g H2O和17.6g CO2 , 消耗氧气13.44L(标准状况下).则该物质的最简式是 , 能否据此确定该有机物的分子式(若能则写出其分子式,若不能请说明理由)
(2)根据价键理论,预测A可能的结构种(不考虑立体异构).
(3)[结构式的确定] 经测定,有机物A分子内有2种不同环境的氢原子,且A能与金属钠反应放出气体,则A的结构简式为 .
(4)[性质实验] A在一定条件下脱水可生成B,B可发生加聚反应生成C,请写出A转化为B的化学反应方程式: .
(5)体育比赛中当运动员肌肉扭伤时,队医随即用氯乙烷(沸点为12.27℃)对受伤部位进行局部冷冻麻醉.请选用B的某同系物和其他试剂及合适的方法制备氯乙烷,要求原子利用率为100%,写出制备反应方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,正确的是
A. 稀硫酸滴在铜片上:Cu + 2H+ = Cu2+ + H2O
B. 氧化镁与稀盐酸混合:MgO +2H+ = Mg2+ + H2O
C. 铜片插入硝酸银溶液中:Cu +Ag+ = Cu2+ + Ag
D. 稀硝酸滴在石灰石上:CaCO3+2H+ = Ca2+ + H2 CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化石燃料及其使用的一些说法中不正确的是( )
A. 煤的气化是指将固态煤粉碎后高温下变为气态,以使煤燃烧时能与氧气充分接触而完全燃烧
B. 天然气除可用作清洁能源外,也可用于合成氨和生产甲醇等
C. 石油分馏得到的汽油和石油催化裂化得到的汽油其成分不相同
D. 化石燃料也是重要的化工原料,乙烯和苯就是分别来自于石油和煤的基本化工原料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银铜合金广泛用于航空工业。从切割废料中回收银并制备铜化工产品的工艺如下: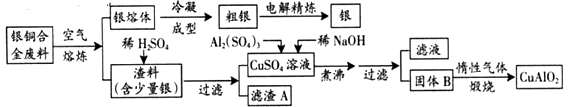
(注:Al(OH)3和Cu(OH)2开始分解的温度分别为450℃和80℃)
(1)固体混合物B的组成为;在生成固体B的过程中,需控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为。
(2)完成煅烧过程中一个反应的化学方程式:。
(3)若银铜合金中铜的质量分数为64%,理论上5.0kg废料中的铜可完全转化为CuAlO2 , 至少需要1.0mol·L-1的Al2(SO4)3溶液 L。
(4)某同学用FeCl3溶液吸收H2S,得到单质硫;过滤后,再以石墨为电极,在一定条件下电解滤液。
①FeCl3与H2S反应的离子方程式为。
②电解池中H+在阴极放电产生H2 , 阳极的电极反应为。
③综合分析实验II的两个反应,可知该实验有两个显著优点:
H2S的原子利用率100%;。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国濒临海域的省份,能够充分利用海水制得多种化工产品。如图是以海水、贝壳(主要成分CaCO3)等为原料制取几种化工产品的工艺流程图,其中E是一种化肥,N是一种常见的金属单质。
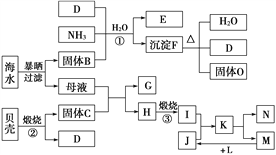
结合上述工艺流程图回答下列问题:
(1)物质G和L的化学式分别为________和________________。
(2)上述工艺流程图中可以循环使用的物质的化学式为______。
(3)反应①的化学方程式为______________________________;在反应①中必须先通入NH3,而后通入D,其原因是____________________。
(4)工业上利用F可制得另一种化工产品,该反应的化学方程式为________________。
(5)由K溶液经如何处理才能制得N?_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,0.1mol/L的HA溶液中 ![]() =1010 , 0.01mol/L的BOH溶液pH=12.请回答下列问题:
=1010 , 0.01mol/L的BOH溶液pH=12.请回答下列问题:
(1)HA是(填“强电解质”或“弱电解质”,下同),BOH是 .
(2)HA的电离方程式是 . 其中由水电离出的c(H+)=mol/L
(3)在加水稀释HA的过程中,随着水量的增加而减小的是(填字母).
A.![]()
B.![]()
C.c(H+)与c(OH﹣)的乘积
D.c(OH﹣)
(4)将等体积等物质的量浓度的HA溶液和BOH溶液混合后的溶液呈性,请用离子方程式解释其原因 , 混合溶液中各离子浓度由大到小的顺序是 .
(5)常温下pH=12的BOH溶液100mL,加0.01mol/L NaHSO4使溶液的pH为11.(混合溶液体积变化忽略不计),应加 NaHSO4mL(保留到小数点后一位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电浮选凝聚法处理酸性污水的工作原理如图.下列说法正确的是( )
A.为增强污水的导电能力,可向污水中加入适量工业用食盐
B.通入甲烷气体的电极反应式为:CH4-8e-+10OH-=CO32-+7H2O
C.若左池石墨电极产生22.4L气体,则消耗0.25mol甲烷
D.铁电极的电极反应式为:Fe-3e-=Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4—SOCl2。电池的总反应可表示为:4Li+2SOCl2=4LiCl+S+SO2。
![]() 请回答下列问题:
请回答下列问题:
![]() (1)电池的负极材料为 ,发生的电极反应为 ;
(1)电池的负极材料为 ,发生的电极反应为 ;
![]() (2)电池正极发生的电极反应为 ;
(2)电池正极发生的电极反应为 ;
![]() (3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。 如果把少量水滴到SOCl2中,实验现象是 ,反应的化学方程式为 ;
(3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。 如果把少量水滴到SOCl2中,实验现象是 ,反应的化学方程式为 ;
![]() (4)组装该电池必须在无水、无氧的条件下进行,原因是 。
(4)组装该电池必须在无水、无氧的条件下进行,原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com