
【题目】Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4—SOCl2。电池的总反应可表示为:4Li+2SOCl2=4LiCl+S+SO2。
![]() 请回答下列问题:
请回答下列问题:
![]() (1)电池的负极材料为 ,发生的电极反应为 ;
(1)电池的负极材料为 ,发生的电极反应为 ;
![]() (2)电池正极发生的电极反应为 ;
(2)电池正极发生的电极反应为 ;
![]() (3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。 如果把少量水滴到SOCl2中,实验现象是 ,反应的化学方程式为 ;
(3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。 如果把少量水滴到SOCl2中,实验现象是 ,反应的化学方程式为 ;
![]() (4)组装该电池必须在无水、无氧的条件下进行,原因是 。
(4)组装该电池必须在无水、无氧的条件下进行,原因是 。
【答案】(1)负极材料为Li(还原剂),Li – e- = Li+
(2)2SOCl2 + 4 e- = 4Cl- + S + SO2
(3)出现白雾,有刺激性气体生成SOCl2 + H2O = SO2 ↑+ 2HCl↑
(4)因为构成电池的两个主要成份Li能和氧气水反应,且SOCl2也与水反应
【解析】分析反应的化合价变化,可得Li为还原剂 ,SOCl2为氧化剂。
(1)负极材料为Li(还原剂),Li – e- = Li+
(2)负极反应式可由总反应减去负极反应式得到:2SOCl2 + 4 e- = 4Cl- + S + SO2
(3)题中给出有碱液吸收时的产物,则没有碱液吸收时的产物应为SO2和HCl,所以现象应该为出现白雾和有刺激性气体生成。
(4)因为构成电池的两个主要成份Li能和氧气水反应,且SOCl2也与水反应


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】煤是一种常用的燃料。由于煤燃烧产生的废气中含有SO2、NO2和NO等多种有害气体和烟尘,会对环境造成污染,因此需要对煤进行加工后再燃烧,或将废气净化后再排放。
(1)将煤直接进行燃烧可能会形成硝酸型酸雨。
①写出有关物质转化为硝酸的化学方程式_________________。
②以下是对硝酸型酸雨的评价,其中正确的是________(用序号填空)。
a.杀死水中的浮游生物,减少鱼类食物来源,破坏水生生态系统
b.对电线、铁轨、桥梁、房屋等均会造成严重损害
c.破坏臭氧层,导致臭氧空洞
d.硝酸与土壤中的矿物质发生作用转化为硝酸盐,给植物提供氮肥
(2)如图是对煤燃烧产生的废气进行常温脱硫处理的基本流程示意图,试写出在废气脱硫并形成副产物的过程中所发生的主要化学反应的化学方程式_______________。
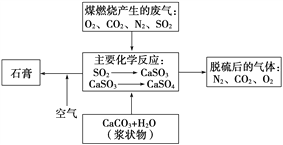
(3)脱硫以后,在废气中含量明显增加的不良气体是(写物质名称)________,它对环境的负面影响是___________________________________________。
(4)检验脱硫后废气中是否含有SO2的简单方法是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于摩尔质量的描述或应用中,正确的是( )
A.1mol OH-的质量为17g/mol
B.二氧化碳的摩尔质量为44g
C.铁原子的摩尔质量等于它的相对原子质量
D.一个钠原子的质量等于23/(6.02×1023)g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液体燃料电池相比于气体燃料电池具有体积小等优点。一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液。下列关于该电池的叙述正确的是
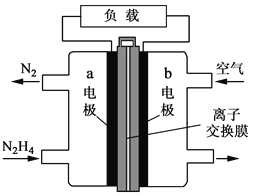
A. b极发生氧化反应
B. a极的反应式:N2H4+4OH--4e-=N2↑+4H2O
C. 放电时,电流从a极经过负载流向b极
D. 其中的离子交换膜需选用阳离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质反应后一定有+3价铁生成的是
① Fe(过量)在Cl2燃烧;② Fe与过量稀H2SO4反应;③ Fe(NO3)2溶液中加少量盐酸;④ FeO和Fe2O3的混合物溶于盐酸中
A. ① ② ④ B. ① ③ ④ C. ① ② ③ D. ② ③ ④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列选项与胶体知识无关的是( )
A. 胶体中分散质粒子的直径大于溶液中分散质的粒子直径
B. 向饱和的氯化铁溶液中加入氢氧化钠溶液得到红褐色沉淀
C. 黄河入海口处形成三角洲
D. 氢氧化铁溶胶、稀豆浆、云雾等均具有丁达尔现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据反应:2H2S+O2=2S↓+2H2O,4NaI+O2+2H2SO4=2I2+2Na2SO4+2H2O,Na2S+I2=2NaI+S↓,下列物质的氧化性强弱判断正确的是
A. O2>I2>S B. H2S>NaI>H2O
C. S>I2>O2 D. H2O>NaI>H2S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组的同学在分析甲酸的组成和结构后,对甲酸的性质提出如下猜想并设计了相关实验加以验证: 猜想Ⅰ:甲酸具有酸性
实验Ⅰ:在甲酸溶液中滴加紫色石蕊试液
猜想Ⅱ:甲酸能发生酯化反应
实验Ⅱ:[装置如图(1)所示]
猜想Ⅲ:甲酸能发生银镜反应
实验Ⅲ:[步骤如图(2)所示]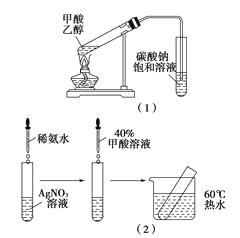
(1)问题Ⅰ:请你进一步设计实验证明甲酸是强酸还是弱酸?
(2)问题Ⅱ:实验Ⅱ能验证猜想Ⅱ吗?;如能,请说明你的理由;如不能,请指出实验Ⅱ中的错误。
(3)问题Ⅲ:分析甲酸的结构,实验Ⅲ中没有出现任何现象的可能原因是。
(4)问题Ⅳ:请你在仔细分析甲酸的组成和结构的基础上,再提出一个关于甲酸性质的猜想并设计实验方案验证你的猜想: ①你提出的猜想是。
②你设计的实验方案是。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com