
【题目】下列关于摩尔质量的描述或应用中,正确的是( )
A.1mol OH-的质量为17g/mol
B.二氧化碳的摩尔质量为44g
C.铁原子的摩尔质量等于它的相对原子质量
D.一个钠原子的质量等于23/(6.02×1023)g
科目:高中化学 来源: 题型:
【题目】下列关于化石燃料及其使用的一些说法中不正确的是( )
A. 煤的气化是指将固态煤粉碎后高温下变为气态,以使煤燃烧时能与氧气充分接触而完全燃烧
B. 天然气除可用作清洁能源外,也可用于合成氨和生产甲醇等
C. 石油分馏得到的汽油和石油催化裂化得到的汽油其成分不相同
D. 化石燃料也是重要的化工原料,乙烯和苯就是分别来自于石油和煤的基本化工原料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电浮选凝聚法处理酸性污水的工作原理如图.下列说法正确的是( )
A.为增强污水的导电能力,可向污水中加入适量工业用食盐
B.通入甲烷气体的电极反应式为:CH4-8e-+10OH-=CO32-+7H2O
C.若左池石墨电极产生22.4L气体,则消耗0.25mol甲烷
D.铁电极的电极反应式为:Fe-3e-=Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知煤油的密度是0.8 g·cm-3,试根据金属钠的保存方法和金属钠与水反应的现象推断金属钠的密度( )
A.小于0.8 g·cm-3B.大于1.0 g·cm-3C.介于0.8~1.0 g·cm-3D.无法推测
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿(CuFeS2)是炼铜的最主要矿物,在野外很容易被误会为黄金,又称愚人金.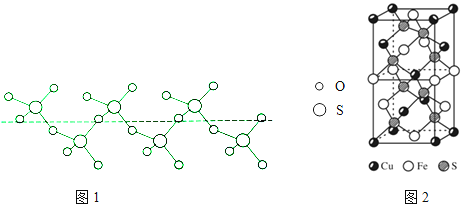
(1)火法冶炼黄铜矿的过程中,利用了Cu2O与Cu2S反应生成Cu单质,反应的化学方程式是
(2)S位于周期表中 族,该族元素氢化物中,H2Te比H2S沸点高的原因是 ,H2O比H2Te沸点高的原因是
(3)S有+4和+6两种价态的氧化物,回答下列问题:
①下列关于气态SO3和SO2的说法中,正确的是 .
A.中心原子的价层电子对数目相等 B.都是极性分子
C.中心原子的孤对电子数目相等 D.都含有极性键
②将纯液态SO3冷却到289.8K时凝固得到一种螺旋状单链结构的固体,其结构如图1,此固态SO3中S原子的杂化轨道类型是
(4)Cu有+1和+2两种价态的化合物,回答下列问题:
①Cu+的价层电子排布为 ,Cu2+有 个未成对电子.
②新制的Cu(OH)2能够溶解于过量浓碱溶液中,反应的离子方程式是
(5)CuFeS2的晶胞如图2所示,晶胞参数a=0.524nm,c=1.032nm;CuFeS2的晶胞中每个Cu原子与 个S原子相连,列式计算晶体密度 ρ= gcm﹣3 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质反应有关现象描述错误的是( )
A.氢气在氯气中燃烧——苍白色火焰
B.钠在空气中燃烧——黄色火焰,且有白色固体生成
C.硫在氧气中燃烧——蓝紫色火焰
D.铜在氯气中燃烧——棕黄色的烟
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4—SOCl2。电池的总反应可表示为:4Li+2SOCl2=4LiCl+S+SO2。
![]() 请回答下列问题:
请回答下列问题:
![]() (1)电池的负极材料为 ,发生的电极反应为 ;
(1)电池的负极材料为 ,发生的电极反应为 ;
![]() (2)电池正极发生的电极反应为 ;
(2)电池正极发生的电极反应为 ;
![]() (3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。 如果把少量水滴到SOCl2中,实验现象是 ,反应的化学方程式为 ;
(3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。 如果把少量水滴到SOCl2中,实验现象是 ,反应的化学方程式为 ;
![]() (4)组装该电池必须在无水、无氧的条件下进行,原因是 。
(4)组装该电池必须在无水、无氧的条件下进行,原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X,Y,Z,W的原子序数依次增大,四种元素同周期,X的金属性再同周期元素中最强,Y原子的电子层数与最外层电子数相等;Z元素在地壳中的含量居于第二位,W的最高价氧化物的水化物的化学式为HnWO2n+2 , 下列说法正确的是( )
A.简单离子半径:X<Y<W
B.Y,Z两种元素的氧化物均具有两性
C.X,W分别形成的氢化物中所含化学键种类相同
D.Z,W形成化合物的电子式为 ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
A.100 mL 2.0 mol?L﹣1 NH4Cl溶液中含有NH ![]() 的数目为0.2NA
的数目为0.2NA
B.25℃时,pH=13的Ba(OH)2溶液中含有OH﹣的数目为0.2NA
C.标准状况下,2.24L庚烷含有的分子数为0.1NA
D.常温常压下,NO2与足量H2O反应生成0.1molNO,则转移的电子数为0.2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com